Генетика в медицине (стр. 1 из 2)
Введение
Генетика человека и такие фундаментальные дисциплины, как анатомия, физиология, биохимия, составляют основу современной медицины. Место генетики среди биологических наук и особый интерес к ней определяются тем, что она изучает основные свойства организмов, а именно наследственность и изменчивость.
Наследственность и изменчивость у человека являются предметом изучения генетики человека на всех уровнях его организации: молекулярном, клеточном, организменном, популяционном. Генетика человека своими успехами в значительной мере обязана медицинской генетике — науке, изучающей роль наследственности в патологии человека. Прикладной раздел медицинской генетики — это клиническая генетика, которая использует достижения медицинской генетики, генетики человека и общей генетики в решении клинических проблем, возникающих у людей.
Генетика представляет собой одну из наиболее сложных дисциплин современного естествознания. Чтобы разобраться в ней глубоко, в своей работе я рассмотрю основные этапы развития генетики, виды генетики, достижения генетики в современной медицине и т.д.
1. История развития генетики
Генетика – это наука, изучающая закономерности наследственности и изменчивости, а также обеспечивающие их биологические механизмы.
Первый научный шаг в изучении наследственности был сделан австрийским монахом Грегором Менделем, который в 1866 г. опубликовал статью «Опыты над растительными гибридами», заложившую основы современной генетики.
До открытий Менделя признавалась теория так называемой слитной наследственности. Суть этой теории состояла в том, что при оплодотворении мужское и женское «начало» перемешивались, «как краски в стакане воды», давая начало новому организму. Мендель показал, что наследственные задатки не смешиваются, а передаются от родителей потомкам в виде дискретных (обособленных) единиц. Эти единицы, представленные у особей парами (аллелями), остаются дискретными и передаются последующим поколениям в мужских и женских гаметах, каждая из которых содержит по одной единице из каждой пары. В 1909 г. датский ботаник-селекционер В. Иогансен назвал их «генами», а в 1912 г. американский генетик Т. Г. Морган показал, что они находятся в хромосомах.
Официальной датой рождения генетики считают 1900 год. Тогда были опубликованы данные Г. де Фриза, К. Корренса и К.Чермака, переоткрывших закономерности наследования признаков, установленные Г.Менделем. Первые десятилетия 20-го века оказались плодотворными в развитии основных положений и направлений генетики. Было сформулировано представление о мутациях, популяциях и чистых линиях организмов, хромосомная теория наследственности, открыт закон гомологических рядов, получены данные о возникновении наследственных изменений под действием рентгеновских лучей, была начата разработка основ генетики популяций организмов.
В 1953 году в международном научном журнале была напечатана статья биологов Джеймса Уотсона и Френсиса Крика о строении дезоксирибонуклеиновой кислоты – ДНК.
Структура ДНК оказалась совершенно необычной: её молекулы имеют огромную по молекулярным масштабам длину и состоят из двух нитей, сплетённых между собой в двойную спираль. Каждую из нитей можно сравнить с длинной нитью бус. У белков «бусинами» являются аминокислоты двадцати различных типов. У ДНК – всего четыре типа «бусин», и зовутся они нуклеотидами. «Бусины» двух нитей двойной спирали ДНК связаны между собой и строго друг другу соответствуют. В ДНК напротив нуклеотида аденина находится тимин, напротив цитозина – гуанин. При таком построении двойной спирали каждая из цепей содержит сведения о строении другой. Зная строение одной цепи, всегда можно восстановить другую.
Получаются две двойные спирали – точные копии их предшественницы. Это свойство точно копировать себя имеет ключевое значение для жизни на Земле.
2. Генетика и медицина
2.1 Методы исследования
В генетике основным методом исследования является генетический анализ, который проводится на всех уровнях организации живого (от молекулярного до популяционного). В зависимости от цели исследования «видоизменяется» в частные методы — гибридологический, популяционный, мутационный, рекомбинационный, цитогенетический и др.
Гибридологический метод позволяет установить закономерности наследования отдельных признаков и свойств организма путем проведения серии прямых или возвратных скрещиваний в ряде поколений. Закономерности наследования признаков и свойств у человека устанавливают, используя генеалогический метод (анализ родословных). Законы наследования признака в популяциях определяют с помощью популяционного метода, или популяционного анализа.
Цитогенетический метод, объединивший принципы цитологического и генетического анализа, применяют при изучении закономерностей материальной преемственности в поколениях отдельных клеток и организмов и «анатомии» материальных носителей наследственности.
Феногенетический анализ позволяет изучать действие гена и проявления генов в индивидуальном развитии организма. Для этого используют такие приемы, как пересадка генетически различных тканей, клеточных ядер или отдельных генов из одной клетки в другую, а также исследование так химер — экспериментально полученных многоклеточных организмов, состоящих из генетически различных клеток, исходно принадлежащих разным индивидуумам.
Мутационный и рекомбинационный анализ используют при изучении тонкой организации и функции генетического материала, структуры различных ДНК, их изменений, механизмов функционирования и обмена генами при скрещивании. Интенсивно развивается метод молекулярного генетического анализа.
2.2 Интерес медицины
С развитием генетики стало возможным применение её методов в исследовании неизлечимых ранее болезней, патологий и т.д. Что начало привлекать немалый интерес со стороны ученых, работающих в области медицины. Известно несколько тысяч генетических заболеваний, которые почти на 100% зависят от генотипа особи. К наиболее страшным из них относятся: кислотный фиброз поджелудочной железы, фенилкетонурия, галактоземия, различные формы кретинизма, гемоглобинопатии, а также синдромы Дауна, Тернера, Кляйнфельтера. Кроме того, существуют заболевания, которые зависят и от генотипа, и от среды: ишемическая болезнь, сахарный диабет, ревматоидные заболевания, язвенные болезни желудка и двенадцатиперстной кишки, многие онкологические заболевания, шизофрения и другие заболевания психики.
Исторически интерес медицины к генетике формировался первоначально в связи с наблюдениями за наследуемыми патологическими (болезненными) признаками. Во второй половине 19-го века английский биолог Ф.Гальтон выделил как самостоятельный предмет исследования «наследственность человека». Он же предложил ряд специальных методов генетического анализа: генеалогический, близнецовый, статистический. Изучение закономерностей наследования нормальных и патологических признаков и сейчас занимает ведущее место в генетике человека.
2.3 Генетика человека
Генетика человека (human genetics) – это особый раздел генетики, который изучает особенности наследования признаков у человека, наследственные заболевания (медицинская генетика), генетическую структуру популяций человека. Из направлений генетики человека наиболее интенсивно развиваются цитогенетика, биохимическая генетика, иммуногенетика, генетика высшей нервной деятельности, физиологическая генетика.
Генетика человека является теоретической основой современной медицины и современного здравоохранения. Её подразделяют на антропогенетику, изучающую закономерности наследственности и изменчивости нормальных признаков человеческого организма, демографическую генетику (генетика народонаселения), экологическая генетику (учение о генетических аспектах взаимоотношений человека с окружающей средой) и генетику медицинскую, которая изучает наследственные патологии (болезни, дефекты, уродства и др.).
Наиболее важной областью генетики человека является медицинская генетика. Медицинская генетика помогает понять взаимодействие биологических и факторов среды в патологии человека. Иногда ее рассматривают не как раздел генетики человека, а как самостоятельную область общей генетики.
2.4 Медицинская генетика
Медицинская генетика изучает явления наследственности и изменчивости в различных популяциях людей, особенности проявления и развития нормальных (физических, творческих, интеллектуальных способностей) и патологических признаков, зависимость заболеваний от генетической предопределенности и условий окружающей среды, в том числе от социальных условий жизни. А также разрабатывает системы диагностики, лечения, профилактики и реабилитации, больных наследственными болезнями и диспансеризации их семей, изучает роль и механизмы наследственной предрасположенности при заболеваниях человека.
Формирование медицинской генетики началось в 30-е гг. XX века, когда стали появляться факты, подтверждающие, что наследование признаков у человека подчиняется тем же закономерностям, что и у других живых организмов.
Задачей медицинской генетики является выявление, изучение, профилактика и лечение наследственных болезней, а также разработка путей предотвращения воздействия факторов среды на наследственность человека.
Основным разделом медицинской генетики является клиническая генетика, которая изучает этиологию и патогенез наследственных болезней, изменчивость клинических проявлений и течения наследственной патологии и болезней, характеризующихся наследственным предрасположением, в зависимости от влияния генетических факторов и факторов окружающей среды, а также разрабатывает методы диагностики, лечения и профилактики этих болезней. Клиническая генетика включает в себя нейрогенетику, дерматогенетику (изучающую наследственные заболевания кожи — генодерматозы), офтальмогенетику, фармакогенетику (изучающую наследственно обусловленные реакции организма на лекарственные средства). Медицинская генетика связана со всеми разделами современной клинической медицины и другими областями медицины и здравоохранения, в том числе, с биохимией, физиологией, морфологией, общей патологией, иммунологией.
МЕДИЦИНСКАЯ ГЕНЕТИКА — Большая Медицинская Энциклопедия
Медицинская генетика (греч. genetikos относящийся к происхождению) — раздел генетики человека, посвященный изучению роли наследственных факторов в патологии человека. Медицинская генетика имеет то же направление исследований и использует те же методы, что и генетика человека (см.).
Основной раздел Медицинской генетики составляет клиническая генетика, к-рая изучает этиологию и патогенез наследственных болезней (см.) и болезней, характеризующихся наследственным предрасположением, а также разрабатывает методы их диагностики, лечения и профилактики. Клиническая генетика включает в себя нейрогенетику, дерматогенетику, изучающую наследственные заболевания кожи — генодерматозы (см.), офтальмогенетику и т. д. Раздел клинической генетики, посвященный изучению наследственно обусловленных реакций на лекарственные средства, называется фармакогенетикой (см.).
Медицинская генетика связана со всеми разделами современной клин, медицины, а также с биохимией, физиологией, морфологией, общей патологией, иммунологией и другими областями медицины и здравоохранения.
Первые представления о передаче наследственных патологических признаков были отражены в литературе конца 18 — начала 19 в. В середине 19 в. в России над проблемами наследственных болезней и наследственной природы человека работал В. М. Флоринский. Большой вклад в становление М. г. внес англ. биолог Гальтон (F. Galton), который в своих работах, опубликованных в конце 19 в., фактически обосновал применение генеалогического метода (см.), близнецового метода (см.) и статистического метода для изучения наследственности человека. Сбор сведений о семье начинался от пробанда — лица, первым попавшего в поле зрения исследователя (см. Пробанд).
В начале 20 в. в генетике (см.) началось формирование ряда направлений, базирующихся на изучении патол, наследственности на основе законов Менделя (см. Менделя законы). Именно к этому времени относится зарождение М. г. как самостоятельного раздела генетики.
В развитии М. г. можно выделить три периода. В первом периоде (начало 20 в.) происходило накопление и анализ фактических данных по наследованию патол, признаков. Наиболее значительным событием этого периода является работа англ. врача Гаррода (A. E. Garrod), в к-рой он в 1908 г. предложил генетическую гипотезу происхождения наследственных болезней обмена, обнаружив взаимосвязь между генами и ферментами. Эта идея в последующем была реализована в виде известного положения «один ген — один фермент». Изучая алкаптонурию (см.), Гаррод первый интерпретировал расщепление признака в семье с точки зрения законов Менделя и обнаружил рецессивный характер наследования этой болезни. Гаррод предполагал существование молекулярной основы восприимчивости к болезням. Кроме того, он описал ряд редких наследственных болезней у детей.
Второй период развития М. г. (20—30-е гг. 20 в.) характеризовался интенсивным изучением патогенеза наследственных заболеваний, болезней, характеризующихся наследственным предрасположением, а также мутационного процесса (см. Мутация). В это время в нашей стране функционировали крупнейшие в мире генетические школы, были открыты кафедры генетики и генетические лаборатории в нескольких институтах. Развитие М. г. в СССР на этом этапе связано с именем клинициста и генетика С. Н. Давиденкова, к-рого следует считать основоположником клин, генетики в нашей стране. Его работы, посвященные генетической гетерогенности наследственных болезней и причинам их клин, полиморфизма, явились фундаментальными для всей клин, генетики.
В начале 30-х гг. 20 в. в Москве был организован Медико-биологический институт, позднее переименованный в Медико-генетический институт (директор — проф. С. Г. Левит), ставший одним из мировых центров медико-генетических исследований. В этом институте интенсивно изучались болезни, характеризующиеся наследственным предрасположением, велись исследования по цитогенетике (см.), разрабатывался близнецовый метод. Основной задачей, поставленной перед коллективом института, было изучение взаимодействия наследственности (см.) и окружающей среды в развитии болезней.
Третий — наиболее интенсивный — период развития Медицинской генетики во всем мире и в нашей стране начался в конце 50-х гг. 20 в. В 1956 г. было установлено точное число и морфология хромосом у человека, а в 1959 г. впервые открыты хромосомные болезни человека (см. Хромосомные болезни). Это существенно стимулировало развитие М. г. В 60-х гг. 20 в. благодаря успехам биохимической и молекулярной генетики началось широкое изучение наследственного биохим, полиморфизма человека и болезней обмена веществ (см. Биохимическая генетика, Молекулярная генетика).
Развитие М. г. неразрывно связано с прогрессом во многих областях теоретической и клин, медицины. Наряду с использованием классических методов (генеалогического, близнецового, цитогенетического, популяционно-статистического) она обогатилась новыми, очень ценными методами, такими как клонирование и гибридизация соматических клеток (см. Генетика соматических клеток), математическое и биол, моделирование, анализ линейной дифференциации хромосом (см.), молекулярно-генетический анализ (см. Генетический анализ).
Медицинская генетика вносит большой вклад в развитие медицины, объясняя причины клин, полиморфизма болезней, разрабатывая новые методы диагностики, лечения и профилактики наследственных болезней. Во многих разделах современной медицины генетические исследования занимают все большее место. Медицина не может быть в полной мере профилактической без генетики, поскольку здоровье человека всегда определяется взаимодействием наследственных факторов и факторов окружающей среды. Объектом наблюдения врача становится не только больной, но и его семья. На основе достижений генетики разрабатываются новые принципы диспансерного обслуживания больных и профилактики заболеваний. Широкое внедрение методов ранней диагностики наследственных болезней, включая внутриутробную (пренатальную) диагностику, эффективных методов лечения и профилактики наследственных болезней будет постоянно способствовать снижению общей заболеваемости, летальности, инвалидизации. Все это свидетельствует о глубокой связи фундаментальных достижений генетики с практикой здравоохранения.
Современная М. г. изучает широкий круг вопросов — от молекулярных явлений до популяционных процессов (см. Популяционная генетика). Во всех этих областях достигнуты успехи, способствующие улучшению диагностики, лечения и профилактики наследственных болезней.
Клин. методы диагностики наследственных болезней не потеряли своей значимости, но открытия в области биохим, генетики и цитогенетики обеспечили возможность описания новых наследственных аномалий и более точную «инвентаризацию» ранее известных болезней. Теперь установлено, что описанные ранее наследственные болезни представляют, как правило, группу клинически сходных, но генетически разных заболеваний (явление генетической гетерогенности). Число вновь выявленных форм наследственных болезней увеличивается с каждым годом. Их известно уже ок. 2000, из них ок. 1000 — это болезни, обусловленные наследственными дефектами обмена, вт. ч. ок. 240 — с биохимически расшифрованным дефектом первичного продукта мутантного гена.
Биохим, и молекулярно-генетическое понимание сущности наследственных болезней привело к разработке ранних и точных методов их диагностики. Для многих нозологических форм стала возможной ранняя диагностика сразу после рождения ребенка и даже внутриутробно либо на уровне первичного белкового продукта гена, либо на уровне других ступеней нарушенного обмена. Разработаны экспресс-методы (см.) диагностики наследственных болезней, которые допускают проведение массового обследования новорожденных или специальных контингентов детей.
Эти методы, приспособленные для нужд практического здравоохранения в нашей стране, широко внедряются на любом уровне медицинского обслуживания (от районного звена до специализированных клиник). Они предназначаются для предположительного выявления наследственных нарушений обмена с помощью простых биохим, исследований мочи и крови. Постановка же окончательного диагноза требует, как правило, применения более сложных методов определения активности ферментов в культуре клеток или других тонких анализов. Наряду с перечисленными методами семейный анализ, подкрепленный современными лабораторными и инструментальными исследованиями, приобретает еще большее значение, чем раньше.
Для дифференциальной диагностики хромосомных болезней и ряда других заболеваний очень многое дают цитогенетические методы. Новые методы окраски позволяют обнаружить различия между отдельными участками разных хромосом, благодаря чему стала возможной диагностика даже незначительных хромосомных перестроек (см. Кариотип).
М. г. наряду с решением вопросов диагностики наследственных болезней занимается выяснением наследственного предрасположения к болезням. Определяются конкретные биол, маркеры тех свойств организма, которые создают предрасположение к болезням. Определенные успехи в этом направлении достигнуты при изучении атеросклероза, шизофрении, злокачественных новообразований, аллергических заболеваний, эмфиземы легких.
Для многих болезней цепь биохимических процессов известна от первичного действия мутантного гена до проявления клин, картины заболевания. Знание патогенеза наследственных болезней дает возможность врачу вмешиваться в их развитие на разных этапах. Существуют следующие виды патогенетического лечения наследственных болезней: ограничение поступления с пищей вещества, обмен к-рого в результате недостаточности фермента, участвующего в превращении этого вещества, завершается образованием токсических продуктов или накоплением не превращающихся далее метаболитов, становящихся также токсичными для организма; добавление определенных продуктов к рациону с целью возмещения несинтезируемых в организме соединений; удаление токсических продуктов обмена из организма. Применяется также оперативное лечение. В отношении наследственных болезней этиологическое лечение пока невозможно, хотя благодаря успехам генной инженерии (см.) постановка такого вопроса правомерна.
Несмотря на успехи в лечении ряда наследственных болезней, существенная роль в борьбе с ними принадлежит профилактике, к-рая осуществляется в двух направлениях: предупреждение возникновения новых мутаций и предупреждение распространения мутаций, унаследованных от предыдущих поколений. Профилактика болезней, возникающих в результате спонтанных мутаций в зародышевых клетках здоровых родителей, пока затруднена. Генетиками разработаны методы, позволяющие оценивать повышение интенсивности мутационного процесса у человека, а также создана строгая и точная система оценки мутагенности факторов окружающей среды. Факторы, наиболее опасные с точки зрения их мутагенности, должны быть изъяты из среды обитания человека. Наибольшее значение для профилактики патол, мутаций, унаследованных от предыдущих поколений, имеют медико-генетические консультации (см.). Все более широкое применение находит пренатальная диагностика, позволяющая в случае необходимости прервать беременность. Рекомендации к проведению пренатальной диагностики дают в медико-генетических консультациях. В профилактике болезней, характеризующихся наследственным предрасположением, главную роль играет устранение вредных факторов, способствующих развитию заболевания.
Исследования по Медицинской генетике проводятся не менее чем в 80 научно-исследовательских учреждениях и высших учебных заведениях страны. В 1969 г. в Москве создан Институт медицинской генетики АМН СССР, который является головным учреждением по проблеме М. г. в СССР. Все научно-исследовательские работы по М. г. координируются Научным советом по генетике при Президиуме АМН СССР. В приказе Министра здравоохранения СССР № 1120 от 31 октября 1979 г. «О состоянии и мерах по дальнейшему улучшению профилактики, диагностики и лечения наследственных болезней» констатируются успехи советской М. г. и говорится о создании в целях дальнейшего совершенствования помощи больным с наследственной патологией центров по медико-генетическому консультированию, по наследственной патологии у детей и по пренатальной наследственной патологии. Во многих зарубежных странах имеются лаборатории, отделы, институты, разрабатывающие проблемы М. г.
Общая генетика изучается студентами-медиками в курсе общей биологии. Лекционный курс по М. г. читается на IV курсе, как правило, на кафедре нервных болезней. Повышение квалификации врачей по М. г. проводится на кафедре биологии с основами генетики ЦОЛИУВ М3 СССР. Более 20 кафедр мед. институтов и отделений научно-исследовательских институтов проводят научные исследования по М. г.
Научные материалы по Медицинской генетике в СССР печатаются в основных клинических журналах, а также в журналах «Генетика» и «Цитология и генетика». За рубежом издаются следующие журналы по М. г.: Amer. J. hum. Genet., Amer. J. med. Genet., J. med. Genet. (Великобритания), Clin. Genet. (Дания), Hum. Genet. (ФРГ), Ann. de Genet. (Франция), J. Genet, hum. (Швейцария), Hum. Hered. (Швейцария), Jap. J. human Genet. (Япония).
Библиография: Антенатальная диагностика генетических болезней, под ред. A. E. X. Эмери, пер. с англ., М., 1977; Бочков Н. П. Генетика человека, М., 1978, библиогр.; Давиденков С. Н. Эволюционно-генетические проблемы в невропатологии, Л., 1947; Давиденкова Е. Ф. и Либерман И. С. Клиническая генетика, Л., 1975, библиогр.; Захаров А. Ф. Хромосомы человека, М., 1977, библиогр.; Маккьюсик В. А. Наследственные признаки человека, пер. с англ., М., 1976; Фролов И. Т. Прогресс науки и будущее человека, М., 1975; Харрис Г. Основы биохимической генетики человека, пер. с англ., М., 1973; Эфроимсон В. П. Введение в медицинскую генетику, М., 1968; The biochemical genetics of man, ed. by D. J. H. Brock a. O. Mayo, L., 1978.
H. П. Бочков.
Урок-конференция «Генетика и медицина»
Цель:
- Объяснить значение комплексного использования методов генетики человека, с целью выявления наследственных заболеваний.
- Дать представление о цитологических и биохимических исследованиях генома человека. Закрепить имеющиеся знания законов генетики.
Оборудование: Таблицы, иллюстрирующие родословные с различным наследованием признаков, набор задач по теме наследование признаков у человека, возможна компьютерная презентация данного материала.
За несколько уроков, группе учащихся дается дополнительное задание подготовить сообщение, для работы в качестве врачей-генетиков во время конференции.
Ход урока
Урок проводиться в виде научной конференции врачей генетиков, работающих в различных направлениях данной науки, по ходу учащимся предлагается решить задачи на наследование определенных признаков человека.
Учитель: Генетика человека — одна из важнейших теоретических основ современной медицины. Академик И.П.Павлов, признавал важное значение генетики для физиологии и медицины, писал: «Наши врачи должны как азбуку знать законы наследственности… Воплощение в жизнь научной истины о законах наследственности поможет избавить человечество от многих скорбей и горя».
Одним из основоположников медицинской генетики является выдающийся советский невропатолог С.Н.Давиденков (1880–1961), начавший свою плодотворную работу в двадцатых годах на Украине. Он впервые применил идеи генетики в клинике, дал анализ ряда наследственных заболеваний, часть из которых была описана им впервые. Важной заслугой С.Н.Давиденкова является разработка методов медико-генетического консультирования и его первое практическое применение в нашей стране.
Особенности генетики человека. Исследование генетики человека связанно с большими трудностями, причины которых связанны с невозможностью экспериментального скрещивания, медленной сменой поколений, малым количеством потомков в каждой семье. Кроме того, в отличие от классических объектов, изучаемых в общей генетике, у человека сложный кариотип, большое число групп сцепления. Однако, несмотря на все эти затруднения, генетика человека успешно развивается.
При изучении генетики человека используются следующие методы: генеалогический, близнецовый, популяционно-статистический, дерматоглифический, биохимический, цитогенетический, гибридизации соматических клеток и метод моделирования.
У человека установлены все 24 теоретически возможные группы сцепления генов; из них 22 локализованы в аутосомах, в каждой из которых содержится по нескольку сот генов. Более 100 генов, локализованы в половых хромосома.
Познакомимся с методами изучения генетики человека, о которых нам сегодня расскажут ученые генетики, работающие по различным направлениям. Слово предоставляется ученому, занимающемуся изучением наследования нормального или патологического признака в ряде поколений людей.
Специалист, занимающийся генеалогией: Генеалогический метод был введен в науку в конце XIX в. Ф.Гальтоном. Суть его состоит в том, чтобы выяснить родственные связи и проследить наличие нормального или патологического признака среди близких и дальних родственников в данной семье.
Сбор сведений начинается с пробанда. Пробандом называется лицо, родословную которого необходимо составить. Братья и сестры пробанда называются сибсами. Обычно родословная составляется по одному или нескольким признакам. Метод включает два этапа: сбор св6едений о семье и генеалогический анализ.
Для составления родословной проводятся краткие записи о каждом члене родословной с точным указанием его родства к пробанду. Затем делают графическое изображение родословной; для составления схемы приняты стандартные символы. (Приложение 1)
После составления родословной начинается второй этап – генеалогический анализ, целью которого является установление генеалогических закономерностей. Данный метод считается наиболее информативным, чем больше имеется достоверных сведений о здоровье родственников больного. В случае обнаружения наследственного характера признака необходимо установить тип наследования: доминантный, рецессивный, сцепленный с полом.
При проявлении признака аутосомно-доминантного наследования – его одинаковая встречаемость у обоих полов, наличие больных во всех поколениях. В случае смерти в более раннем возрасте никаких данных о возможной болезни этого члена семьи, естественно, нет, но имеется вероятность заболевания потомков.
При проявлении рецессивных заболеваний нередко встречается кровное родство родителей больных. Иногда наличие родства бывает неизвестно членам семьи.
Существует тип наследования, сцепленного с полом. Заболевания, обусловленные геном, локализованным в X-хромосоме, могут быть как доминантные, так и рецессивными. При доминантном Х-сцепленом наследовании заболевание одинаково проявляется как у мужчин, так и у женщин и в дальнейшем может передаваться потомству. Решим несколько задач на такой тип наследования. (Приложение 2)
Генеалогический метод, безусловно, является связующим звеном между теоретической генетикой человека и применением ее достижений в медицинской практике. Хотя генеалогический метод является одним из самых давних, его возможности далеко не исчерпаны благодаря использованию новых, более совершенных методов анализа фенотипа, выявлению гетерозиготных носителей, учету факторов среды и т.п.
Специалист, занимающийся изучением близнецов: Близнецовый метод, один из наиболее ранних методов изучения генетики человека, однако он не утратил своего значения и в настоящее время. Близнецовый метод был введен Ф. Гальтоном, который выделил среди близнецов две группы: однояйцовые (монозиготные) и двуяйцовые (дизиготные). Как правило, у человека рождается один ребенок, но в среднем один случай на 84 новорожденных составляют двойни. Около одной трети их числа — монозиготные близнецы при нормальном эмбриональном развитии всегда одного пола.
Дизиготные близнецы рождаются чаще (2/3 общего количества двоен), они развиваются из двух одновременно созревших и оплодотворенных яйцеклеток. Такие близнецы могут быть и однополые и разнополые; с генетической точки зрения они сходны как обычные сибсы, но у них большая общность факторов среды во внутриутробном (пренатальном) и частично в постнатальном периодах. В первый период применения этого метода проводили сравнение близнецов по внешним морфологическим признакам: цвет волос, глаз, пигментация кожи, форма носа, глаз, губ, ушных раковин, пальцевые узоры и т.п. эти признаки, как известно наследственно обусловлены. Если изучаемый признак проявляется у обоих близнецов пары, их называют конкондартными (от лат. быть согласным, сходным). Коркондантность – это процент сходства по изучаемому признаку. Отсутствие признака у одного из близнецов – дискордантность.
Близнецовый метод используется в генетике человека для того, чтобы оценить степень влияния наследственности и среды на развитие какого-либо нормального или патологического признака. При сопоставлении данных (Приложение 3) видно, что наряду с наследственным компонентом значительную роль играют условия среды, при которых происходит реализация генотипа в фенотип.
Специалист работающий с популяционно-статистическим методом: Данный метод позволяет изучать распространение отдельных генов в человеческих популяциях. Обычно производится непосредственное выборочное исследование части популяции либо изучают архивы больниц, родильных домов, а также проводят опрос путем анкетирования. Выбор способа зависит от цели исследования. Последний этап состоит в статистическом анализе. Одним из наиболее простых и универсальных математических методов является метод, предложенный Г. Харди и В. Вайнбергом. Результатом, которого является возможность определения генетической структуры популяций (соотношение между частотой Гомозигот и гетерозигот). Знание генетического состава популяций населения имеет большое значение для социальной гигиены и профилактической медицины.
Специалист изучающий метод дерматоглифики: Дерматоглифика (гр. кожа и рисовать) – это изучение рельефа кожи на пальцах, ладонях и подошвенных поверхностях стоп. В отличие от других частей тела здесь имеются эпидермальные выступы – гребни, которые образуют сложные узоры.
Еще в древности в Китае и Индии обратили внимание на то, что рисунки кожных узоров на пальцах и ладонях строго индивидуальны, и использовались отпечатки пальцев вместо подписи. На земле нет двух людей с одинаковыми рисунками на пальцах (кроме монозиготных близнецов). В 1892 г. Ф. Гальтон предложил классификацию этих узоров, позволившую использовать этот метод для идентификации личности в криминалистике. Таким образом, выделился один из разделов дерматоглифики – дактилоскопия (изучение узоров на подушечках пальцев). Другие разделы дерматоглифики – пальмоскопия (рисунки на ладонях) и плантоскопия (изучение дерматоглифики подошвенной поверхности стопы).
Последнее время данные методы стали использоваться в качестве дополнительного для подтверждения диагноза хромосомных синдромов у людей с изменениями кариотипа.
Специалист работающий с биохимическими методами: Эти методы используются для диагностики болезней обмена веществ, причиной которых является изменение активности определенных ферментов. С помощью биохимических методов открыто около 500 молекулярных болезней, являющихся следствием проявления мутантных генов. При различных типах заболеваний удается либо определить сам аномальный белок-фермент, либо промежуточные продукты обмена. Эти методы отличаются большой трудоемкостью, требуют специального оборудования и потому не могут быть широко использованы для массовых исследований с целью раннего выявления больных с наследственной патологией обмена. Поэтому, для массовых исследований применяются различные экспресс методы, микробиологические тесты, позволяющие определить наличие продуктов обмена в различных средах организма.
Специалист работающий с цитогенетическим методом: Принципы цитогенетических исследований сформировались в течении 20-30-х годов на классическом объекте генетики – дрозофиле и на некоторых растениях. Метод основан на микроскопическом исследовании хромосом.
Нормальный кариотип человека включает 46 хромосом, из них 22 пары аутосом и 2 половые хромосомы. До 1956 г. количество хромосом у человека не было точно установлено, это удалось шведским ученым Д. Тийо и А. Левану. В 1960 году была разработана первая Международная классификация хромосом человека. В основу были положены особенности величины хромосом, формы, расположение первичной перетяжки. хромосомные болезни – это обширная группа наследственных патологических состояний, причиной которых являются изменения количества хромосом или нарушения их структуры. Существует много аномалий кариотипа и причин их возникновения: Аномалии аутосом. Наиболее известными из них являются трисомия-21 (болезнь Дауна), трисомия-13 (синдром Патау), трисомия-18 (синдром Эдварса). аномалии количества половых хромосом в кариотипе были обнаружены еще в 1916 г. К. Бриджесом у дрозофилы. Спустя несколько десятилетий выводы из опытов Бриджеса помогли расшифровать некоторые описанные ранее патологические состояния у человека, природа которых была не извесна. Аномалии количества половых хромосом могут быть в виде моносомий и полисомий. Моносомия-Х (синдром Шершевского-Тернера), Трисомия-Х, Синдром Клайнфельтера. в отличие от мутантных генов они не накапливаются в популяциях, однако их частота не убывает за счет первичного возникновения мутаций.
Специалист изучающий метод гибридизации соматических клеток: Соматические клетки содержат весь объем генетической информации. Это дает возможность изучать многие вопросы генетики человека, которые невозможно исследовать на целом организме. Благодаря методам генетики соматических клеток человек стал как бы одним из экспериментальных объектов. Соматические клетки человека получают из различных органов (кожа, косный мозг, клетки крови, ткани эмбрионов). Чаще всего используют клетки соединительной ткани (фибробласты) и лимфоциты крови. Культивирование клеток вне организма позволяет получить достаточное количество материала для исследования, что не всегда можно взять у человека без ущерба для здоровья. применение данного метода генетики дает возможность изучить механизмы первичного действия генов и взаимодействия генов. Культуры клеток используются для определения мутагенного действия факторов окружающей среды. Расширяют возможности точной диагностики наследственных болезней на биохимическом уровне у взрослых и до рождения плода (пренатальная диагностика). Для дальнейшего совершенствования данного метода необходимо накапливать линии клеток с генными мутациями. В России и США уже организованы «банки» клеточных линий.
Специалист занимающийся методом моделирования: Теоретическую основу биологического моделирования в генетике дает закон гомологич
Конспект «Значение генетики для медицины»
Значение генетики для медицины
Ключевые слова: медико-генетическое консультирование; дородовая диагностика; амниоцентез; болезни: наследственные, врождённые.
Раздел ЕГЭ: 3.7. Значение генетики для медицины…
В последнее время учёные установили у человека множество заболеваний, появление которых обусловлено наследственными факторами. Правильное распознавание этих патологий важно для их профилактики, диагностики и лечения. Всё это стало возможным лишь после того, как были разработаны методы генетического исследования наследственности человека. Для профилактики наследственных заболеваний человека проводят медико-генетическое консультирование. Основная его цель — предупреждение рождения детей с генетическими аномалиями.
Медико-генетическое консультирование.
Первый кабинет медико-генетического консультирования был организован в 1941 г. в Мичиганском университете (США). В России кабинеты медико-генетического консультирования появились в 1967 г. в Москве и Ленинграде (С.-Петербург), а с 1973 г. они стали открываться и в других городах.
Консультирование начинается с составления генеалогической карты и уточнения диагноза. Проводятся биохимические и цитогенетические исследования. Далее врач-генетик анализирует родословную и прогнозирует вероятность рождения больного ребёнка. При составлении прогноза учитывается характер наследственного заболевания, его повторение среди родственников. В случае единичной патологии, когда заболевание не носит семейного характера, выясняются возможные причины возникновения аномалии. Это могут быть геномные или хромосомные мутации, возникшие в гаметах родителей или на ранних этапах развития плода. После этого врач оценивает генетический риск и даёт рекомендации. Степень риска выражается в процентах. Считается, что 0—10 % — низкая степень риска, 11—20 % — средняя степень, более 21% — высокая степень. В последнем случае деторождение в данной семье не рекомендуется. Основными задачами таких консультаций являются:
- консультирование семей с наследственной и врождённой патологией;
- объяснение пациенту и его семье о риске рождения больного ребёнка;
- предупреждение родственных браков, в результате которых вероятность рождения больного ребёнка резко возрастает;
- выявление носителя аномального гена;
- дородовая диагностика, позволяющая выявить ряд заболеваний генной природы и хромосомные аномалии.
Кроме частных задач, связанных с предупреждением генетических аномалий в отдельных семьях, существует общая цель медико-генетического консультирования — снижение груза патологической наследственности в популяции человека как биологического вида.
Дородовая диагностика плода.
Прогноз появления вероятного потомства, осуществляемый в медико-генетических консультациях, не позволяет однозначно ответить, здоровым или больным родится ребёнок. Более надёжны методы дородовой диагностики, направленные на выявление отклонений в развитии, установление тех или иных заболеваний у плода. Наиболее распространёнными являются ультразвуковая диагностика и исследование околоплодной жидкости. Ультразвуковое исследование позволяет установить морфологические пороки развития: конечностей, почек, сердца, головного мозга и др. Разные формы пороков диагностируются на разных стадиях беременности.
Наибольшее значение имеет исследование околоплодной жидкости — амниоцентез. Известно, что в ней содержатся вещества, выделяемые развивающимся зародышем, а также некоторое количество зародышевых клеток. На 16-й неделе беременности с помощью шприца берётся проба амниотической жидкости в количестве 15—20 мл. После центрифугирования клетки плода выращиваются в культуральной среде в течение двух недель. Далее проводится микроскопическое исследование хромосом. В случае обнаружения серьёзных нарушений беременность рекомендуют прервать. Современные методы позволяют диагностировать более 60 наследственных заболеваний.
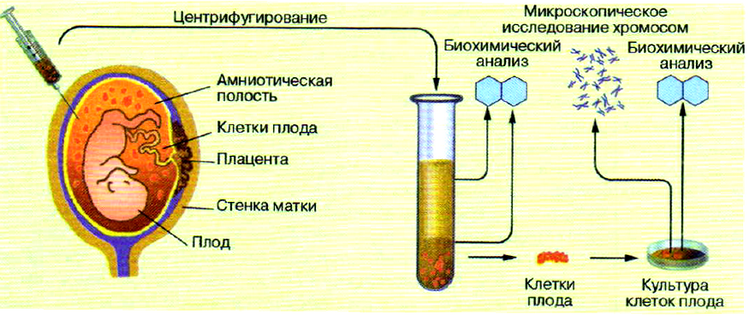
Исследование околоплодной жидкости (амниоцентез)
Наследственные и врождённые заболевания.
В генетике и медицине наряду с термином наследственные болезни существует термин врождённые заболевания. К наследственным относят заболевания, которые связаны с нарушением генетического (наследственного) аппарата половых клеток родителей. Они могут проявляться сразу при рождении или в более поздние периоды.
Врождённые заболевания также проявляются сразу при рождении, но причины их могут быть различны. Они бывают наследственными или возникают в процессе эмбрионального развития. В последнем случае эти болезни не передаются по наследству. Известно, что если женщина на раннем периоде беременности перенесла какое-либо вирусное заболевание, например краснуху, то у детей могут возникнуть пороки сердца, почек, лёгких, мозга и т. д. Однако не у всех беременных женщин, перенёсших сходную вирусную инфекцию, рождаются дети с врождёнными пороками.
Хорошо известен факт появления уродств у детей, матери которых принимали во время беременности в качестве снотворного лекарственный препарат талидомид, выпущенный в 1958 г. в Германии. Оказалось, что он вызывал у новорождённых такие аномалии, как отсутствие или недоразвитие конечностей, недоразвитость ушных раковин и глаз, пороки сердца, почек и др.
Вредными факторами для беременной женщины являются вирусные и бактериальные инфекции, некоторые пищевые добавки, алкоголь, наркотики, отравляющие токсические вещества, а также различные виды облучения. К особенно тяжёлым последствиям приводит влияние этих повреждающих факторов на ранних стадиях беременности (от 2 до 20 недель), когда закладывается нервная система, все органы и ткани эмбриона.
Разграничение врождённых и наследственных заболеваний имеет важное значение при прогнозировании потомства в семье.
Значение генетики для диагностики и лечения наследственных заболеваний.
Наследственные заболевания определяются особенностями генотипа организма, однако это не означает, что медицина не может с ними бороться. В случае ранней диагностики многие заболевания удаётся лечить, предотвращая последствия развития аномалий.
В настоящее время во всех роддомах проводится массовая проверка детей для выявления фенилкетонурии и врождённого недостатка гормона щитовидной железы. Наличие фенилкетонурии диагностируется путём исследования мочи новорождённых с помощью специального индикатора. Начатое на ранних стадиях лечение и специальная диета помогают избежать пороков умственного и физического развития у таких детей. Медицина не может изменить генетическую природу человека, однако она владеет достаточными методами и средствами для лечения и предупреждения его наследственных аномалий.
Для успешного медико-генетического консультирования необходима пропаганда генетических знаний среди населения и осведомлённость о наследственных болезнях человека.
Расширенный список значений генетики для медицины
- Клиническая область медицины
Диагностика наследственных и инфекционных болезней.
Патогенетическое лечение наследственных болезней.
Генотерапия наследственных, вирусных и онкологических заболеваний.
Производство лекарств на основе генной инженерии.
Все виды профилактики наследственных болезней. - Теоретическая область медицины
Углубление «инвентаризации» болезней по нозологическому принципу.
Расшифровка патогенеза болезней.
Причины хронического течения болезней.
Фармакогенетика. - Профилактическая область медицины
Генетико-гигиеническое нормирование факторов окружающей среды.
Предупреждение мутагенных, тератогенных и канцерогенных эффектов.
Создание новых вакцин.
Это конспект для 10-11 классов по теме «Значение генетики для медицины». Выберите дальнейшее действие:
МЕДИЦИНСКАЯ ГЕНЕТИКА • Большая российская энциклопедия
-

-

-

В книжной версии
Том 19. Москва, 2011, стр. 502-503
-

Скопировать библиографическую ссылку:
Авторы: Е. К. Гинтер
МЕДИЦИ́НСКАЯ ГЕНЕ́ТИКА, раздел частной генетики, посвящённый изучению роли наследственных факторов в возникновении патологии у человека. М. г. зародилась в недрах евгеники. Как самостоят. раздел генетики развивается с нач. 20 в. Большое значение для становления М. г. имели труды Ф. Гальтона, прежде всего предложенные им генеалогический, т. н. близнецовый и статистич. методы для изучения наследственности. Наиболее значит. событием в начальном периоде развития М. г. явилась публикация в 1909 доклада «Врождённые ошибки метаболизма» англ. врача А. Э. Гаррода (1857–1936), в котором он впервые описал наследств. болезни обмена веществ и связал их происхождение с нарушением генетич. контроля за метаболич. процессами, подойдя, т. о., к изучению молекулярных основ ряда наследственных болезней. Гаррод считал, что продукция и активность ферментов контролируются определёнными генами (отсюда известное положение: «один ген – один фермент»). В 1920–30-е гг. происходило интенсивное изучение патогенеза наследств. болезней и болезней с наследств. предрасположенностью, а также мутационного процесса (см. Мутагенез). Важное значение для развития М. г. в этот период имели труды отеч. учёных: С. Н. Давиденкова, Н. К. Кольцова, А. С. Серебровского, В. В. Бунака, А. А. Прокофьевой-Бельговской, А. Ф. Захарова и др. Особенно интенсивное развитие М. г. в значит. мере было связано с реализацией междунар. проекта «Геном человека» (практически завершён к нач. 21 в.). В 1956 были установлены точное число и морфология хромосом у человека, а в 1959 обнаружены хромосомные болезни. С 1960-х гг. началось широкое изучение наследств. биохимич. полиморфизма человека и болезней обмена веществ.
Анализ исследований в области М. г. позволяет утверждать, что практически вся патология человека в той или иной мере связана с влиянием наследств. факторов. Согласно генетич. классификации, все болезни человека подразделяют: на моногенные, причиной которых являются изменения (мутации) отд. генов; хромосомные болезни, вызываемые хромосомными перестройками; митохондриальные, возникающие в связи с мутациями митохондриальной ДНК; т. н. болезни импринтинга, обусловленные активацией или супрессией отд. генов в процессе гаметогенеза. Известны ок. 6000 моногенных болезней (гены для более 2000 из них картированы и клонированы), ок. 1000 хромосомных синдромов, 30 митохондриальных заболеваний и неск. десятков болезней импринтинга. Кроме того, выделяют группу т. н. мультифакторных (мультифакториальных) заболеваний, развитие которых связано со взаимодействием мн. генов, формирующих предрасположенность к заболеваниям, с факторами внешней среды, способствующими реализации генетич. предрасположенности. Эта группа наиболее обширна и наименее генетически изучена. Она включает большинство изолиров. врождённых пороков развития, все хронич. неинфекционные заболевания (атеросклероз, ишемич. болезнь сердца, диабет, бронхиальная астма и др.). Для выявления генов предрасположенности к мультифакторным заболеваниям широко используют анализ ассоциаций и сцепления этих генов с генетич. маркерами, перекрывающими весь геном, – т. н. полногеномный скрининг. М. г. разрабатывает спец. методы диагностики наследств. болезней. Напр., моногенные заболевания выявляют с помощью клинико-генеалогического, молекулярно-генетического (позволяет идентифицировать мутации в определённых генах) методов, а также методов ДНК-диагностики. Биохимич. методы широко используют в определении болезней обмена веществ, цитогенетические и молекулярно-цитогенетические методы – в диагностике хромосомных болезней.
Достижением М. г. явилось введение (нач. 1960-х гг.) в мед. практику скрининга новорождённых с целью выявления среди них потенциально больных некоторыми нарушениями обмена веществ, напр. фенилкетонурией, гипотиреозом, адреногенитальным синдромом (расстройство функции коры надпочечников), галактоземией (нарушение углеводного обмена) и муковисцидозом. Особая роль отведена популяционному генетич. скринингу для выявления гетерозиготных носителей некоторых рецессивных наследств. болезней, часто встречающихся в определённой популяции (напр., β-талассемия в ряде стран Средиземноморья).
М. г. разрабатывает методы патогенетич. лечения не только скринируемых заболеваний, но и ряда др. наследств. болезней обмена веществ, а также гемофилии А и В, недостаточности α-1-антитрипсина и некоторых др. заболеваний, как правило, посредством введения т. н. генно-инженерного продукта; разрабатываются методы генотерапии разл. заболеваний, прежде всего рака, некоторых форм наследств. иммунодефицита. Созданы эффективные методы дородовой и доимплантационной (проводимой до внедрения яйцеклетки в стенку матки) диагностики практически всех хромосомных и мн. моногенных заболеваний. В рамках М. г. сформировались такие направления, как фармакогенетика и фармакогеномика, позволяющие индивидуализировать применение лекарственных средств без побочных эффектов и использовать достижения геномики с целью поиска новых мишеней для лечения разл. заболеваний. Одним из наиболее важных практич. достижений М. г. является медико-генетическое консультирование. Издаётся ж. «Медицинская генетика» (с 2002).
МЕДИЦИНА НА ПОРОГЕ РЕВОЛЮЦИИ | Наука и жизнь
Образец анализа на генетическую предрасположенность человека к раку легких, хроническому бронхиту и эндометриозу.
Наука и жизнь // Иллюстрации
‹
›
Наступающий ХХI век многие провозглашают веком генетики. Современную
генетику, изучающую химические механизмы наследственности, называют молекулярной
геномикой. Сегодня молекулярная геномика _ приоритетное направление научных
исследований. Она влияет на развитие науки в целом и здравоохранения и
медицины в частности. Молекулярная геномика создала предпосылки решения
таких ключевых вопросов современной науки, как происхождение человека (филогенез),
возникновение рас и наций, пути их расселения по планете (этногенез), развитие
организма из одной единственной клетки (онтогенез), проблема клонирования
млекопитающих и человека. «Генетизация» общества происходит буквально на
наших глазах. А это, в свою очередь, не может не привести к качественным
изменениям и в медицинской науке: в ней наступает эпоха молекуляр ной медицины.
Что же такое молекулярная медицина? Это — диагностика, лечение и профилактика
наследственных и ненаследственных болезней на генном уровне.
ЧЕМ МОЛЕКУЛЯРНАЯ МЕДИЦИНА ОТЛИЧАЕТСЯ ОТ ОБЫЧНОЙ?
Уже в подходе к постановке диагноза молекулярная медицина принципиально
отличается от обычной. Главный вопрос традиционной медицины: «Чем вы болеете?»,
а молекулярной: «Чем вы можете заболеть при вашем геноме?». То есть молекулярная
медицина выявляет генетическую предрасположенность человека к различным
болезням.
Следующая отличительная черта молекулярной медицины — лечение заболеваний
(как наследственной, так и ненаследственной природы) проводится на генном
уровне. В качестве лекарственного препарата выступают гены (точнее _ специальные
генетические конструкции). Генная терапия не просто устраняет определенные
симптомы заболевания, а корректирует функции клеток и организма в целом.
Её терапевтический эффект может достигаться различными путями: замена «больного»
гена на «здоровый», направленная коррекция структуры и, соответственно,
функции «больного» гена, частичное или полное подавление «больного» гена.
И, наконец, еще один важный принцип молекулярной медицины: любое медикаментозное
лечение должно подбираться строго индивидуально, учитывая особенности генома
больного. Оно должно подгоняться под пациента, как костюм под заказчика.
Этим занимается недавно возникшая наука — фармакогенетика.
ОПРЕДЕЛЕНИЕ ГЕНОВ НАСЛЕДСТВЕННЫХ И НЕНАСЛЕДСТВЕННЫХ
БОЛЕЗНЕЙ
Уже сегодня практическое применение молекулярной медицины весьма разнообразно.
Это — и молекулярная диагностика наследственных заболеваний на любой стадии
развития организма, в том числе и до рождения (пренатальная диагностика),
и определение генов предрасположенности к некоторым распространенным болезням,
и геномная «дактилоскопия» — точная идентификация личности на основе анализа
особенностей структуры его генома (именно этот метод был с успехом применен
при генетическом анализе останков царской семьи).
В геноме человека насчитывается 35-50 тысяч различных генов, изменения
в некоторых из них приводят к нескольким тысячам наследственных болезней.
Гены практически всех наиболее частых (около 320) и сравнительно редких
(около 170) наследственных болезней уже известны. Методы их обнаружения
достаточно просты и универсальны и поэтому широко применяются в медицине.
Выявление генов наследственных болезней на ранних сроках беременности
(с десятой недели) позволяет предотвратить рождение больного ребенка. Впервые
в нашей стране внутриутробный диагноз (гемофилия — несвертываемость крови)
был поставлен в 1989 году в Санкт-Петербурге в Институте акушерства и гинекологии
имени Д. О. Отта. Затем здесь же впервые в России пренатальная диагностика
позволила выявить также такие тяжелейшие генные патологии, как муковисцидоз,
миодистрофия Дюшенна, фенилкетонурия, синдром ломкой Х-хромосомы.
Прекращение беременности — хотя и эффективный, но достаточно грубый
способ охраны генофонда и здоровья живущего поколения. Поэтому значительно
более привлекательным представляется выявление бессимптомных взрослых носителей
того или иного наследственного заболевания. Обязанность врача — предупредить
такого человека о вероятности рождения у него больного ребенка и оценить
степень риска.
Сейчас у нас в стране можно определить около 40 наиболее тяжелых наследственных
болезней. Молекулярная диагностика генов наследственных болезней проводится
в НИИ акушерства и гинекологии в Санкт-Петербурге, в Научном центре медицинской
генетики и Институте неврологии РАМН в Москве, в Институте биохимии и генетики
научного центра РАН в Уфе, в Институте медицинской генетики в Томске и
в Медико-генетическом центре в Новосибирске.
Методы молекулярной диагностики позволяют выявить не только гены наследственных
болезней, но и гены предрасположенности к тому или иному заболеванию. Среди
болезней, вызванных наличием в геноме генов предрасположенности, различают
заболевания «с поздним началом» и мультифакториаль ные болезни. Заболевания
с «поздним началом» (например, рак молочной железы, хорея Гентингтона,
болезнь Альцгеймера, семейный полипозный рак толстого кишечника, ряд нейродегенеративных
заболеваний) генетически могут быть обнаружены уже при рождении ребенка,
однако видимые симптомы развиваются в более позднем возрасте. Мультифакториальные
болезни (например, диабет, гипертония, атеросклероз, некоторые онкологические
заболевания) также определяются при рождении, но проявляют ся только при
неблагоприятных внешних факторах.
И в том и в другом случае молекулярная
диагностика дает возможность врачу поставить диагноз задолго до появления
симптомов болезни и, если это возможно, заблаговременно принять профилактические
меры или начать лечение.
У нас в институте, взяв у пациента лишь одну каплю крови, ученые-медики
могут определить изменения более чем в десяти генах предрасположенности.
В частности, с помощью такого анализа можно абсолютно достоверно установить
склонность человека к раку легких, раку простаты, эндометриозу, астме,
остеопорозу.
Гены предрасположенности — объект исследования многих научных групп
по всей России. Так, в Санкт-Петербурге на кафедре медицинской генетики
Педиатрической академии активно изучаются гены предрасположенности к тромбофилии,
варикозному расширению вен, сердечно-сосудистым заболеваниям, диабету,
атеросклерозу; в Институте экспериментальной медицины РАМН исследуются
гены гиперхолестеринемии, приводящие к атеросклерозу и хроническим заболеваниям
легких и печени, а в НИИ онкологии имени профессора Н. Н. Петрова — гены
предрасположенности к опухолям легких и молочной железы. Работы по этой
тематике проводятся в Москве: во Всероссийском кардиологическом центре
РАМН, в Институте молекулярной генетики РАН и во Всероссийском онкологическом
центре РАМН, а также в Томске — в Институте медицинской генетики.
Молекулярная геномика уже применяется в Европе и Соединенных Штатах
для решения разнообразных задач медицины и медицинской генетики. Например,
в Великобритании созданы инфомационные центры, и каждый, позвонивший туда,
может получить консультацию по любым вопросам, касающимся своей наследственности
и генетической предрасположенности к различным заболеваниям. Во Франции
создана и используется на практике компьютерная экспертная система Сезам
(SESAM — Systeme Expert Specialisee aux Analyses Medicales) для определения
склонности человека к различным заболеваниям. Она включает собственно экспертную
систему оценки риска возникновения заболевания, основанную на многочисленных
лабораторных (иммунологических, биохимических, серологических и генетических)
тестах (более 80), программу для обучения врачей основам молекулярной медицины,
медицинское консультирование по результатам лабораторных тестов и популярный
справочник для населения. Программа прекрасно зарекомендовала себя во Франции,
и хочется верить, что российские медики в недалеком будущем тоже смогут
ее использовать.
ГЕННАЯ ТЕРАПИЯ
В настоящее время в мире около 400 проектов по генной терапии находятся
на различных стадиях клинических испытаний: 261 из них проходит первую
стадию (оценка токсичности), 133 — вторую (испытание на небольшой группе
тяжелобольных пациентов) и только 3 проекта (два по лечению рака мозга
и один по гемофилии) — на заключительной третьей стадии (масштабные клинические
испытания). Пока генная терапия применяется в основном в онкологии (более
60% проектов). Примерно по 15% приходится на генную терапию инфекционных
(СПИД, гепатит В, туберкулез) и моногенных заболеваний (муковисцидоз, семейная
гиперхолестеринемия, мукополисахаридозы, гемофилия А и др.).
Методы генной терапии позволяют лечить различные генетические патологии
в период внутриутробно го развития. Введенный ген или генная конструкция
попадает во множество интенсивно делящихся клеток, предотвращая начало
развития заболевания. После такой терапии нет необходимости искусствен
ного прерывания беременности — ребенок рождается здоровым. Но тем не менее
вопрос о ее целесообразности поднимается все чаще и чаще — теоретически
существует опасность внедрения искусствен ных генных конструкций в геном
половых клеток, что может привести к «засорению» генофонда.
Генная терапия успешно применяется для лечения не только наследственных,
но и значительно более распространенных мультифакториальных болезней (диабет,
остеопороз, ревматоидный артрит, различные опухоли). Для лечения таких
заболеваний применяется не одна, а сразу много генетических конструкций,
исправляющих дефекты различных стадий течения патологического процесса.
К сожалению, из всех проектов по генной терапии, утвержденных Американским
и Европейским комитетами по генной терапии, нет ни одного проекта из России
или стран СНГ. Тем не менее научные работы в этой области ведутся и в России.
В Институте акушерства и гинекологии имени Д. О. Отта РАМН разрабатыва
ются новые подходы к генной терапии таких тяжелых наследственных заболеваний,
как мышечная дистрофия Дюшенна и муковисцидоз. Работы по генной терапии
также проводятся в научных учреждениях Москвы (Институт молекулярной биологии
имени В. А. Энгельгардта РАН, Институт молекулярной генетики РАН, Институт
медицинской химии РАМН, Научный центр медицинской генетики РАМН) и Новосибирска.
ГЕНЕТИЧЕСКИЙ ПАСПОРТ
Недалек тот день, когда по совокупности анализов мы сможем определить
весь комплекс генов предрасположенности каждого человека. То есть теоретически
создание «генетического паспорта» гражданина вполне реально. Такой «паспорт»
должен содержать информацию о наличии в геноме генов наследственных болезней
и, что особенно важно, — генов предрасположенности к мультифак ториальным
заболеваниям.
Уже сегодня имеются все научные предпосылки для широкого внедрения «генетической
паспортизации». Более того, в Западной Европе, США и Канаде в неполном
варианте она проводится по различным медицинским показаниям и просто по
индивидуальному желанию. Формируются индивидуальные и семейные базы генетических
данных, и, следовательно, стихийный процесс «паспортизации» уже начался.
Но серьезно говорить о всеобщей «генетической паспортизации» явно преждевременно.
Она потребует не только уже накопленных наукой знаний, но и правильной
интерпретации результатов тестирования врачами разных специальностей. Значит,
прежде всего необходимо провести всеобщее обучение медиков основам молекулярной
геномики. Кроме того, такая «паспортизация» таит в себе потенциальные опасности,
связанные со свободой и правами личности, с решением множества социальных,
юридических и правовых норм, касающихся интерпретации и применения результатов
генетического тестирова ния. Пока неясно, кто и как станет обеспечивать
конфиденциальность генетических данных, кто будет иметь к ним доступ, какие
институты здравоохранения займутся формированием таких баз данных, будет
ли генетическая информация приниматься во внимание при вступлении в брак,
страховании, приеме на работу и многое другое.
Молекулярная медицина эти социально-правовые проблемы решить не может,
да и не сможет. Общество само должно созреть для того, чтобы применение
научных достижений современной генетики принесло людям больше пользы, чем
вреда. И средства массовой информации могут сыграть в этом далеко не последнюю
роль.
Показательно в этой связи то широкое обсуждение проблем тестирования
генетической предрасположенности, которое развернулось в средствах массовой
информации во всем мире. До нашей страны дошли лишь отголоски зарубежных
публикаций. Пока в России объективных научных предпосылок для проведения
массовой «генетической паспортизации» не видно. Но вот парадокс — страх
перед «генетической переписью населения» уже успел укорениться в общественном
сознании россиян.
Подведем итоги. Молекулярная геномика развивается стремительно. Ее прорыв
в практическую медицину в Европе и Америке уже произошел и скоро будет
ощутим в мировом масштабе. Для цивилизованных стран этот прорыв в перспективе
означает рождение генетически здорового потомства, значительное удлинение
средней продолжительности жизни, здоровую старость.
Эпоха социальных и экономических реформ в России в конце ХХ века совпала
по времени с мировой революцией в биологии. Это привело к катастрофическим
последствиям для всей отечественной биологической науки вообще и для генетики
в частности. Хочется надеяться, что Россия, где молекулярная геномика пока
еще находится на начальных, зачаточных стадиях развития, все же когда-нибудь
станет в этом плане страной цивилизованной. Но пока в нашей стране век
геномики, а тем более молекулярной медицины еще не настал, да и российское
общество к его приходу не готово.
Многие юридические, этические и социальные аспекты этой сложной проблемы
пока не решены и в развитых странах, где, однако, они активно разрабатываются.
Задача российских ученых-генетиков, практических врачей и организаторов
здравоохранения — по крайней мере, не отстать от мирового процесса утверждения
юридических и правовых норм молекулярной медицины. Это позволит нашей стране
даже при современном весьма скромном научном потенциале быстро и эффективно
воспользоваться плодами «генетического древа познания», выращенного, к
сожалению, не нами.
Доктор медицинских наук В. БАРАНОВ, профессор Санкт-Петербургского
государственного университета, заведующий лабораторией пренатальной диагностики
наследственных и врожденных болезней Института акушерства
и гинекологии имени Д. О. Отта РАМН (г. Санкт-Петербург).
Медицинская генетика — это… Что такое Медицинская генетика?
раздел генетики человека, посвященный изучению роли наследственных факторов в патологии человека на всех основных уровнях организации жизни — от популяционного до молекулярно-генетического.
Основной раздел М.г. составляет клиническая генетика, которая изучает этиологию и патогенез наследственных болезней (Наследственные болезни), изменчивость клинических проявлений и течения наследственной патологии и болезней, характеризующихся наследственным предрасположением, в зависимости от влияния генетических факторов и факторов окружающей среды, а также разрабатывает методы диагностики, лечения и профилактики этих болезней. Клиническая генетика включает в себя нейрогенетику, дерматогенетику (изучающую наследственные заболевания кожи — генодерматозы), офтальмогенетику, фармакогенетику (изучающую наследственно обусловленные реакции организма на лекарственные средства). Медицинская генетика связана со всеми разделами современной клинической медицины и другими областями медицины и здравоохранения, в т.ч. с биохимией, физиологией, морфологией, общей патологией, иммунологией.
Медицинская генетика зародилась в недрах евгеники — теории о наследственном здоровье человека и путях его улучшения. Евгеника базировалась на во многом ошибочной теории исключительно наследственной обусловленности всех признаков у человека, в т.ч. психических, и пыталась предложить приемы искусственного негативного и позитивного отбора, которые способствовали бы улучшению вида Homo sapiens.
В конце 19 в. и начале 20 в. в генетике (Генетика) началось формирование ряда направлений, базирующихся на изучении патологической наследственности на основе законов Менделя. Именно к этому времени относится зарождение М.г. как самостоятельного раздела генетики. Большой вклад в становление М.г. внес английский биолог Гальтон (F. Gallon), который фактически обосновал применение генеалогического, близнецового и статистического методов для изучения наследственности человека. Использование евгеники для обоснования расовой теории и геноцида в фашистской Германии привело к ее дискредитации, которая с конца 30-х гг. 20 в. распространилась отчасти и на медицинскую генетику.
В развитии М.г. можно выделить три периода. В первом периоде (начало 20 в.) происходили накопление и анализ фактических данных по наследованию патологических признаков. Наиболее значительным событием этого периода является работа английского врача Гаррода (А.Е. Garrod), в которой он предложил гипотезу происхождения наследственных болезней обмена веществ, базирующуюся на взаимосвязи между генами и ферментами (1908). Эта идея в последующем была реализована в виде известного положения «один ген — один фермент». Изучая алкаптонурию, Гаррод первый интерпретировал расщепление признака в семье с точки зрения законов Менделя и установил рецессивный характер наследования этой болезни. Гаррод высказал предположение о существовании молекулярной основы восприимчивости к болезням. Кроме того, он описал ряд редких наследственных болезней у детей.
Второй период развития медицинской генетики (20—30-е гг. 20 в.) характеризуется интенсивным изучением патогенеза наследственных болезней и болезней, характеризующихся наследственным предрасположением, а также мутационного процесса (см. Мутагенез). В это время в СССР функционировали крупнейшие в мире генетические школы, были открыты кафедры генетики и генетические лаборатории в нескольких институтах. Развитие М.г. в СССР в эти годы связано с именем С.Н. Давиденкова. Работы С Н. Давиденкова, посвященные генетической гетерогенности наследственных болезней и причинам их клинического полиморфизма, остались фундаментальными для всей клинической генетики. В начале 30-х гг. 20 в. в Москве был организован Медико-биологический институт, позднее переименованный в медико-генетический институт, ставший одним из мировых центров медико-генетических исследований. В нем интенсивно изучались болезни, характеризующиеся наследственным предрасположением, велись исследования по цитогенетике, разрабатывался близнецовый метод. Основной задачей, поставленной перед коллективом института, было изучение взаимодействия наследственности и окружающей среды в развитии болезней. Весомый вклад в развитие М.г. в СССР внесли Н.К. Кольцов, А.С. Серебровский, В.В. Бунак, С.Г. Левит, А.Ф. Захаров, А.А. Прокофьева-Бельговская.
Третий, наиболее интенсивный период развития М.г. начался в США, Великобритании и некоторых других странах после второй мировой войны. Достижения М.г. стали использоваться в практических целях (см. Медико-генетическое консультирование). В 1956 г. были установлены точное число и морфология хромосом у человека, а в 1959 г. обнаружены так называемые хромосомные болезни человека. С 60-х гг. 20 в. благодаря успехам биохимической и молекулярной генетики началось широкое изучение наследственного биохимического полиморфизма человека и болезней обмена веществ.
Развитие М.г. связано с прогрессом во многих областях теоретической и клинической медицины. В медицинской генетике практически нет специфических методов исследования. Обычно используются те же методы, что и в генетике человека, цитогенетике и молекулярной генетике: методы популяционно-генетического анализа для изучения поведения мутантных генов, вызывающих наследственную патологию, в популяциях человека; методы сегрегационною анализа для определения типа наследования тех или иных заболеваний или их отдельных признаков; методы установления соотносительной роли наследственных и внешнесредовых факторов и вычисления наследуемости для анализа мультифакториальных заболеваний; методы анализа сцепления по отношению к генам наследственных болезней. Для установления типа наследования заболевания в основном применяют генеалогический метод, который позволяет тестировать соответствие наблюдаемого отношения больных и здоровых детей в семьях с изучаемым заболеванием к ожидаемому отношению при определенной генетической гипотезе, Наиболее существенным моментом сегрегационного анализа является выбор метода регистрации семей, в которых имеются больные наследственными болезнями. Обычно семьи регистрируются через одного пораженного — пробанда, однако возможны и другие способы регистрации. В настоящее время разработаны методы комплексного сегрегационного анализа, позволяющие учитывать как различную вероятность выявления семей, где имеются больные, так и наличие в выборке определенной доли спорадических случаев.
Для установления соотносительной роли наследственности и среды в формировании предрасположенности к заболеваниям используют модели мультифакториального наследования и близнецовый метод. Оценкой значимости наследственных факторов в развитии такого качественного признака, как болезнь при изучении близнецов, является установление степени конкордантности (поражения обоих близнецов в близнецовой паре). В силу ограничений как биологического, так и статистического характера близнецовый метод самостоятельно в генетическом анализе используется редко.
Моделирование наследственных болезней человека на животных, широко применяющееся в экспериментальной М.г., позволяет решать не только чисто генетические вопросы: существование генетической гетерогенности некоторых наследственных болезней, генетическая организация сложных локусов, регуляция активности Генов и др., но и вопросы патогенеза наследственных болезней, особенно врожденных пороков развития, и разработки методов генетической инженерии (Генетическая инженерия) в аспекте генной терапии.
В популяционной М.г., генетическом анализе, анализе сцепления широко применяется математическое моделирование с использованием компьютерной техники.
Открытия в области биохимической генетики и цитогенетики позволили обнаружить новые наследственные аномалии. Как правило, выявляется, что та или иная известная ранее наследственная болезнь представляет группу клинически сходных, но генетически разных состояний (явление генетической гетерогенности). Число вновь выявленных форм наследственных болезней увеличивается с каждым годом. Растет количество впервые описанных наследственных заболеваний. По данным Мак-Кьюзика (V.A. McKusick) на 1986 г. описано 2201 аутосомно-доминантных, 1420 аутосомно-рецессивных и 286 доминантных и рецессивных заболеваний, сцепленных с полом. Чрезвычайно велико разнообразие хромосомных болезней: известно более 800 различных хромосомных аберраций, частичных или полных анеуплоидий, приводящих к различным нарушениям развития, как правило, тяжелым.
Существенными достижениями в области клинической генетики явились расшифровка биохимической и молекулярно-генетической природы большого числа моногенных наследственных болезней и разработка на этой основе точных методов диагностики. Первичный биохимический дефект на уровне мутантного гена (структурного или ферментного белка) известен сейчас для более чем 300 нозологических форм. Наиболее интенсивно пополняется список установленных первичных биохимических дефектов для лизосомных, пероксисомных и некоторых других групп наследственных болезней обмена веществ.
Применение методов генетической инженерии позволило точно выяснить характер перестроек в структуре мутантных генов для целого ряда наследственных болезней, в т.ч. талассемий (α,β, δ, γ), миопатий Дюшенна и Беккера, гемофилии А и В, фенилкетонурии; исследования в этой области осуществляются так интенсивно, что любые данные быстро становятся устаревшими.
Для клинической генетики актуальной остается проблема изучения клин, полиморфизма наследственной патологии. С генетической точки зрения, основными причинами клинического полиморфизма наследственных болезней являются генетическая гетерогенность и изменение проявления главного гена под влиянием других генов или факторов окружающей среды. На возможность генетической гетерогенности наследственных болезней, сходных по клиническим проявлениям, впервые указал С.Н. Давиденков еще в 30-е гг. 20 в., однако реальные успехи в ее изучении появились после введения в научную практику методов биохимического, молекулярно-биологического и молекулярно-генетического анализа. Генетическая гетерогенность может быть обусловлена как мутациями в разных локусах, контролирующих определенный метаболический путь (например, мукополисахаридозы), так и разными мутациями в одном локусе (β-талассемии). Достижения молекулярной генетики показывают, что чрезвычайно широко распространенные так называемый полиаллелизм и многие наследственные болезни, прежде представлявшиеся генетически однородными, являются результатом различных мутаций (генетическая гетерогенность фенил, кетонурии, миопатии Дюшенна, болезни Тея — Сакса и др.). Менее значимы достижения в изучении изменения проявлений главного гена под влиянием других генов или факторов окружающей среды, однако этот путь исследований остается основным в анализе генетического механизма патогенеза наследственных болезней на всех уровнях проявления заболевания — от молекулярного до формирования клинических симптомов.
Методы и технологии получения рекомбинантных ДНК позволяют выделять и анализировать структуру мутантных генов даже в тех случаях, когда их функциональная значимость и первичный белковый продукт остаются неизвестными. Именно так исследовали структуру мутантного гена при миопатий Дюшенна, хорее Гентингтона, муковисцидозе и ряде других наследственных болезней.
В области генетики мультифакториальных заболеваний, к которым относятся ишемическая болезнь сердца, психозы, сахарный диабет, язвенная болезнь, большинство изолированных пороков развития, по-видимому, некоторые инфекционные заболевания (туберкулез, лепра, ревматизм), интенсивно развиваются теоретические исследования в области особого направления М.г. — генетической эпидемиологии. Не менее важным в генетике мультифакториальных заболеваний является также выяснение значимости факторов окружающей среды, в т.ч. социальных, а также их взаимодействия с генетическими факторами для развития широко распространенных заболеваний.
К мультифакториальным заболеваниям непосредственно примыкают онкологические заболевания. Несмотря на идентификацию довольно большого числа специфических нуклеотидных последовательностей, являющихся протоонкогенами и онкогенами, сохраняется представление о сложной природе генетической предрасположенности к онкологическим заболеваниям и механизмов ее реализации.
Хромосомные болезни и ряд других наследственных заболеваний успешно диагностируют с помощью цитогенетических методов. Методы дифференциальной окраски хромосом позволили точнее, чем раньше, различать различные хромосомные болезни, особенно обусловленные частичными моно- и трисомиями, и выявить значительное число новых хромосомных синдромов. В 80-х гг. 20 в. цитогенетика обогатилась высокоразрешающими методами анализа хромосом на ранних стадиях митоза (см. Клетка), а также методами молекулярной цитогенетики. Это позволило выявить тонкие структурные перестройки хромосом, в частности микроделеции и сбалансированные транслокации. Предполагают, что микроделеции и дупликации являются причиной возникновения ряда синдромов, которые прежде считались «свежими» доминантными мутациями, в т.ч. синдромов де Ланге, Лангера — Гидеона, аниридии в сочетании с нефробластомой и умственной отсталостью, ретинобластомы и др. Еще более точную идентификацию отдельных небольших участков хромосом обеспечивают методы молекулярной цитогенетики.
Для некоторых наследственных болезней цепь биохимических процессов изучена от первичного проявления мутантного гена до клинической картины заболевания. Знание патогенеза наследственных болезней дает возможность врачу вмешиваться в их развитие на разных этапах. Существуют следующие виды патогенетического лечения наследственных болезней: ограничение поступления с пищей вещества, обмен которого в результате недостаточности фермента, участвующего в превращении этого вещества, завершается накоплением не превращающихся далее метаболитов, становящихся токсичными для организма; добавление определенных продуктов к рациону с целью возмещения несинтезируемых в организме соединений; удаление токсических продуктов обмена из организма. Этиологическое лечение в отношении наследственных болезней пока невозможно, хотя благодаря успехам молекулярной генетики и генетической инженерии постановка такого вопроса правомерна.
Одним из направлений исследований в М.г. является популяционная генетика наследственных болезней, включающая исследования по спонтанному и индуцированному мутагенезу. Основное содержание этих исследований состоит в изучении значимости отдельных факторов популяционной динамики, в т. ч. генетической структуры популяции, ее демографических, миграционных характеристик, разнообразных внешнесредовых условий и др. в возникновении и распространении мутаций и формировании груза наследственных болезней. Изучение груза наследственных болезней в популяциях ведется различными способами, например через так называемые регистры наследственной и врожденной патологии. По данным одного из лучших в мире регистров (округ Британская Колумбия, Канада), груз наследственных заболеваний аутосомно-доминантных, аутосомно-рецессивных и рецессивных, сцепленных с полом, составляет соответственно 1,4; 1,7 и 0,5 на 1000 новорожденных. Хромосомные аномалии встречаются с частотой 1,8 на 1000 новорожденных. Частота встречаемости всех врожденных пороков развития составляет более 79 больных на 1000 новорожденных, из них почти половина приходится на врожденные пороки развития, в этиологии которых существенную роль играют генетические факторы.
В ряде стран, в том числе и в нашей, ведутся обширные исследования по изучению связи между генетической структурой популяций и распространенностью в этих популяциях наследственных болезней. Исследования как спонтанного, так и индуцированного мутационного процесса у человека производятся на новом, более высоком уровне. Кроме традиционного цитогенетического (анализ частоты хромосомных аберраций) и морфологического (анализ частоты доминантных мутаций, резко снижающих приспособленность носителей) подхода и подхода, заключающегося в определении некоторых витальных показателей (спонтанных абортов, мертворождений, частоты встречаемости ряда врожденных пороков развития), все большее применение находят методы изучения мутаций на уровне ДНК, а также белков.
Изучение мутационного процесса у человека непосредственно связано с генетическим мониторингом, то есть динамическим изучением состояния мутационного груза в популяциях.
Несмотря на успехи в лечении ряда наследственных болезней существенная роль в борьбе с ними принадлежит профилактике, которая осуществляется в двух направлениях: предупреждение появления новых мутаций и распространения мутаций, унаследованных от предыдущих поколений. Профилактика болезней, возникающих в результате спонтанных мутаций в зародышевых клетках здоровых родителей, пока затруднена. Наибольшее значение для профилактики проявления патологических мутаций, унаследованных от предыдущих поколений, имеет медико-генетическое консультирование. В работе медико-генетических консультаций происходит все более заметный сдвиг от обеспечения вероятностного прогноза для консультирующейся семьи к точной идентификации фенотипа или даже генотипа потомства. Возможности для такой индентификации постоянно расширяются, охватывая все более широкий круг заболеваний, в основном благодаря внедрению разнообразных методов дородовой цитогенетической, биохимической и ДНК-диагностики. Все большее применение находит пренатальная диагностика. Список наследственных заболеваний, диагностика которых может быть осуществлена пренатально, в том числе с использованием методов амниоцентеза и биопсии ворсин хориона, включает более 30 нозологических форм так называемых менделирующих заболеваний, практически все хромосомные болезни, многие грубые врожденные пороки развития.
При некоторых наследственных болезнях обмена веществ биохимические проявления мутантных генов предшествуют появлению клинических симптомов; в ряде таких случаев разработаны методы эффективного терапевтического купирования клинических проявлений при своевременном выявлении биохимического дефекта, обусловливающего заболевания. Эти два обстоятельства послужили основанием для разработки первых программ массового скрининга (просеивания) новорожденных с целью выявления потенциальных больных некоторыми видами наследственных болезней обмена веществ. Первые программы массового скрининга были начаты в 60-е гг 20 в. в отношении фенилкетонурии и галактоземии. В настоящее время во многих популяциях широко проводится скрининг в отношении фенилкетонурии, гипотиреоза, врожденной гиперплазии надпочечников, некоторых наследственных болезней обмена веществ. Массовый скрининг дополняется подтверждающей диагностикой и назначением соответствующего лечения, что обеспечивает практически полную реабилитацию потенциальных больных. Следует также указать на скрининг супружеских пар с целью выявления гетерозиготного носительства некоторых мутантных генов. Этот вид скрининга, будучи дополнен соответствующими методами пренатальной диагностики, позволяет эффективно снижать в популяции число больных с определенной наследственной патологией. Впервые скрининг был применен для выявления супружеских пар, гетерозиготных по гену болезни Тея — Сакса, в некоторых еврейских общинах США. В настоящее время скрининг супружеских пар используется в ряде стран для выявления гетерозиготного носительства генов, вызывающих β-талассемию. Для скрининга супругов на гетерозиготное носительство все шире применяют ДНК-диагностику. Этот метод скрининга имеет большие перспективы в профилактике всех частых наследственных болезней, в первую очередь муковисцидоза и фенилкетонурии. Разрабатываются также профилактические мероприятия на социальном уровне, направленные на выявление и устранение демографических и популяционно-генетических факторов, способствующих росту груза наследственных болезней.
Этиологическая коррекция наследственных болезней может быть достигнута только через генную терапию. Созданы все предпосылки для применения методов генетической инженерии с целью введения в клетки больного организма нормального гена или даже замещения мутантного гена нормальным. Однако для успешного использования генной терапии у человека еще придется решить ряд принципиальных вопросов, связанных с обеспечением генетической безопасности.
Эффективное внедрение научных достижений М.г. в практическое здравоохранение может осуществляться только на основе подготовки квалифицированных кадров. Во многих странах, в том числе в США, Канаде, ФРГ, сложилась система подготовки кадров по медицинской генетике, в которой особое место отведено 2—4-летнему постдипломному обучению врачей, заканчивающемуся экзаменами и выдачей соответствующего сертификата. Кроме того, в большинстве случаев в рамках подготовки специалистов по М.г. предусматривается специализация по цитогенетике и клинической генетике. В перечень медицинских специальностей в СССР введены специальности врача-генетика и врача лаборанта-генетика, подготовка которых осуществляется на кафедрах медицинской генетики в медицинских вузах и институтах усовершенствования врачей.
Библиогр.: Бочков Н.П., Захаров А.Ф. и Иванов В.И. Медицинская генетика, М., 1984: Захаров А.Ф. и др. Хромосомы человека, М., 1482; Козлова С.И. и др. Наследственные синдромы и медико-генетическое консультирование, Л., 1987; Маккьюсик В.А. Наследственные признаки человека, пер. с англ., М., 1976; Перспективы медицинской генетики, под ред. Н.П. Бочкова, М., 1982.
Что такое геномная медицина? Введение в генетику в здравоохранении
Ученые и врачи изучают гены и наследственные состояния (передаваемые от родителей к ребенку) в течение многих лет. В наши дни кто-то может пройти генетический тест на целый ряд заболеваний. Берут образец крови и тщательно исследуют на предмет аномальных хромосом, но, поскольку в ДНК хранится так много информации, ученые склонны искать только определенные нарушения.
Что такое геномная медицина
Геномная медицина — это изучение наших генов (ДНК) и их взаимодействия с нашим здоровьем. Genomics исследует, как биологическая информация человека может быть использована для улучшения его клинической помощи и улучшения здоровья (например, посредством эффективной диагностики и индивидуального лечения.
В то время как генетика изучает конкретные гены или группы «букв» вдоль цепи ДНК, геномика относится к изучению всего генетического состава человека. Речь идет о том, как они связаны и реагируют друг с другом, и связано с состояниями, которые имеют более широкий спектр триггеров, таких как диабет, болезни сердца, рак и астма.
Как геномика используется в медицине?
- Диагностика — например, когда причину ряда симптомов невозможно определить никакими другими способами.
- Пренатальные тесты, которые проводятся во время беременности — либо для скрининга (на случай, если с ребенком что-то не так), либо там, где уже есть семейный анамнез. Это помогает родителям делать осознанный выбор и строить планы на будущее.
- Если в семейном анамнезе есть серьезные генетические нарушения, он может сказать потенциальным родителям, являются ли они носителями и могут ли они передать это своим детям.Он также может сказать кому-то, есть ли у него вероятность развития унаследованного состояния в более позднем возрасте, даже если у него еще нет никаких симптомов.
- Для оценки риска — генетический состав человека может показать его предрасположенность к определенным заболеваниям, таким как болезни сердца, инсульт и рак. Возможно, у них высокий уровень холестерина или проблемы с венами. Обладание этими знаниями означает, что они могут управлять риском с помощью лекарств, медицинского вмешательства или внесения положительных изменений в образ жизни.
Пути, которыми геномная медицина имеет значение
Это более глубокое понимание связи между биологией и болезнями приносит пользу на нескольких уровнях.
- Персональный — у каждого пациента есть лекарства, лечение и план медицинского обслуживания с учетом его индивидуальных потребностей и рисков. В качестве примера возьмем лечение рака прямой кишки. Некоторые люди с определенной мутацией гена имеют лучшие показатели выживаемости при лечении нестероидными противовоспалительными средствами, такими как аспирин, чем люди без этой мутации. 1
- Врачи — доступ к геномной информации помогает в диагностике, лечении и выявлении симптомов у более широкой группы пациентов. Было несколько случаев, когда диагноз церебрального паралича пересматривался в свете генетического тестирования, выявляя новый диагноз и, как следствие, новый эффективный план лечения. 2
- Национальный уровень — разработка стратегий по уходу за растущими тенденциями и конкретными сообществами и программами, такими как скрининг новорожденных в U.S., который исследует от 29 до 50 тяжелых, но поддающихся лечению состояний. 3
- В мировом масштабе — такие проекты, как онлайн-Менделирующее наследование в человеке 4 , база данных с открытым доступом обо всех известных генетических состояниях человека. Такой подход означает, что родители детей с редкими синдромами с большей вероятностью получат ответы и необходимую поддержку.
Чего мне ожидать и что такое генетическое консультирование?
Есть несколько типов поставщиков услуг.В Великобритании, например, в Национальной службе здравоохранения работают 90 клинических генетиков-консультантов в 25 центрах. Их поддерживают сотни специально обученных сотрудников. 5 Направление обычно осуществляется терапевтом (терапевтом или семейным врачом) и доступно тем, кто обеспокоен серьезным генетическим семейным заболеванием или семейной тенденцией к развитию рака, или родителям ребенка с трудностями в обучении и другими проблемами развития. проблемы, требующие экспертной оценки.
В местах, где государственная услуга недоступна, или для тех, кто решает обратиться за частным медицинским обслуживанием, убедитесь, что клиника, которую вы посещаете, имеет необходимую регистрацию (например, в Великобритании это осуществляется через Комиссия по качеству обслуживания, также известная как CQC 6 ), и лаборатория также правильно аккредитованы.
Какими бы ни были условия, встреча может занять некоторое время, и вам может потребоваться привести с собой других членов вашей семьи. Ваша семья и история болезни будут нанесены на карту и изучены, и, вероятно, вы тоже пройдете медицинское обследование.Обнаружение того, что в вашем будущем может измениться жизнь или ограничить ее, является серьезным и, для некоторых, травмирующим опытом. Наряду с консультированием вам могут быть предложены анализы (в том числе анализы крови) — с возможностью сделать их в тот же день или, если вам нужно время, чтобы подумать о возможных последствиях, вернуться позже.
На получение результатов могут уйти недели или даже месяцы (в зависимости от редкости генетической аномалии и того, насколько легко ее найти), но результаты пренатальных тестов будут возвращены гораздо раньше.
Последующий уход зависит от результатов и характера того, на что вы проходите тестирование. Некоторых людей направят обратно к семейному врачу с подробными сведениями, или они могут продолжить лечение в специализированном отделении. Тем, у кого нет симптомов, будет оказана поддержка и советы по изменению образа жизни, чтобы свести к минимуму их риск, а также советы по управлению их потенциальным состоянием в будущем.
Есть также ряд частных компаний, которые предлагают генетическое тестирование по почте.Он включает в себя взятие мазка из щеки или анализ крови в местной клинике. Затем его отправляют в лабораторию. Проверяются такие вещи, как генетический риск диабета и сердечных заболеваний, а также информация о происхождении. Некоторые компании предоставляют больше услуг, чем другие, имея под рукой консультантов или других специалистов в области здравоохранения. Это удобно (но не обязательно дешево), но следует помнить, что это генетическое тестирование без обычного уровня комплексной поддержки, который можно найти в известных клиниках.
Будущее
Широкая область, известная как геномная медицина, находится в стадии развития — изучение путей генетических мутаций и их вариаций особенно интересно. Но что это означает для людей на практическом уровне? Как обсуждалось ранее, есть некоторые наследственные заболевания, которые трудно диагностировать просто из-за большого количества задействованных генов.
Ученые работают над поиском химического или генетического «узкого места» для подобных состояний. Возможность выключить жизненно важную реакцию на пути от генетического триггера до сенной лихорадки, аллергии на пыль или астмы, например, поможет диагностировать и лечить, и, возможно, будут ли эти черты вызывать страдания для следующего поколения. 7
Эпигенетика
Возникающая область эпигенетики продвигает эту идею на один шаг вперед. Он основан на концепции, согласно которой каждый ген имеет свой собственный химический тег, который сообщает гену, как ему действовать. Можно выключить ген (сделать его бездействующим) или включить (сделать активным) в соответствии с его химической меткой. Таким образом, генетический код остается прежним, но меняется способ его выражения. 8
Это очень интересная разработка. Если такие вещи, как то, что мы едим и пьем, и сколько мы спим, влияют на то, как проявляется наш генетический код, каковы последствия для болезней и старения? Времена, когда гены переключаются из здорового нормального состояния в состояние, вызывающее болезнь и конец жизни?
Эти химические модификации также могут быть переданы следующему поколению, создавая более изменчивый уровень генетического наследования.Другими словами, ваш выбор образа жизни может отрицательно или положительно повлиять на здоровье вашего ребенка на базовом, биологическом уровне.
Время подумать
Достижения в области геномной медицины означают, что можно диагностировать и лечить больше заболеваний, как редких, так и более распространенных, чем когда-либо прежде. Но есть несколько вещей, которые следует учитывать:
- Наша судьба в наших генах? В зависимости от генетического дефекта болезнь не всегда является исходом, и симптомы могут задерживаться или вообще не проявляться.Какие проверки существуют для защиты от несправедливой дискриминации и предрассудков?
- Имея доступ к предимплантационным тестам, позволяющим определить все, от пола эмбриона до конкретных генетических мутаций, кто принимает решение о том, какие дети получат шанс на жизнь?
- В какой степени врачи могут полагаться на генетическую медицину в диагностике и терапии? Может ли это привести к чрезмерной уверенности, неправильному диагнозу или пропущенным симптомам?
- Как правительства и другие директивные органы используют информацию, собранную в рамках международных геномных проектов?
Понимая то, что уже записано в нашем генетическом коде, мы можем предсказывать и управлять тем, что произойдет в будущем.Новые достижения в геномной медицине создают среду, в которой мы можем составлять обоснованные планы медицинского обслуживания, обращаться за советом и лечиться на жизненно важных ранних стадиях заболевания.
На личном уровне это не ограничивается нами — принципы, лежащие в основе эпигенетики, предполагают, что наши повседневные привычки — что мы едим и курим — могут иметь положительное или отрицательное влияние на биологию наших внуков, а это означает, что наше генетическое наследие также стоит позаботиться. В Aetna International мы можем покрыть генное тестирование в индивидуальном порядке, например, если онкологу необходимо определить наиболее подходящее лечение для участника, больного раком.
Прочтите нашу статью: Как генетическая информация может поддержать здоровье вашей семьи: руководство.
Чтобы получить дополнительную информацию о международном медицинском страховании и получить доступ к лучшему медицинскому обслуживанию для вас и вашей семьи, свяжитесь с одним из опытных консультантов по продажам Aetna International сегодня.
Если вы работодатель или брокер, ищущий международную частную медицинскую страховку для клиентов или сотрудников, вы можете позвонить нам, чтобы обсудить ваши потребности. Получите номер телефона, подходящий для вашего региона, здесь.
Aetna ® является товарным знаком Aetna Inc. и защищен во всем мире регистрациями товарных знаков и международными соглашениями.
,
Молекулярная генетика и медицина | Рецензируемый журнал
Journal of Molecular Genetics and Medicine публикует новые, рецензируемые исследовательские статьи, краткие сообщения, отчеты о случаях, обзорные статьи и многое другое в широких разделах молекулярной биологии, генетики, хромосомной структуры, транскрипции и перевода и их применения в медицине. генной терапией. Молекулярная медицина — это обширная область, в которой физические, химические, биологические, биоинформатические и медицинские методы используются для описания молекулярных структур и механизмов, выявления фундаментальных молекулярных и генетических ошибок болезни и разработки молекулярных вмешательств для их исправления.
Рукописи, представленные авторами, послужат полезными ресурсами для будущей работы в этой области. В качестве альтернативы рукописи могут описывать новый метод анализа данных, который может применяться к общедоступным наборам данных. Представленные рукописи должны отражать новый подход к основным неизлечимым заболеваниям. Система редакционного менеджера обеспечивает удобную для пользователя подачу, рецензирование и публикацию статей. Рукописи, прошедшие тщательную рецензирование, гарантируют соответствие лучшим стандартам в отрасли.Статьи будут обрабатываться в электронном виде, изучаться научным комитетом и анонимными оценщиками и публиковаться ежемесячно в форматах HTML и PDF.
Отправьте рукопись на https://www.imedpub.com/submissions/molecular-genetics-medicine.html или отправьте в виде вложения по электронной почте в редакцию по телефону [электронная почта защищена]
«Молекулярная генетика человека» — это исследование молекулярных основ наследственного заболевания человека, генетики развития, нейрогенетики, структуры и емкости хромосом, молекулярных аспектов генетики злокачественных новообразований, генной терапии, биохимической генетики, значительных достижений в области картирования генов и понимания ассоциации генома.
Рак — это обычно болезнь регуляции роста тканей. В целом, чтобы обычная клетка превратилась в болезненную, необходимо отрегулировать качества, контролирующие развитие и разделение клеток. Пораженные гены разделены на две общие классификации. Онкогены — это гены, которые способствуют росту и пролиферации клеток. Гены глушителя опухоли — это гены, подавляющие деление и выживание клеток. Опасные изменения могут произойти из-за развития новых онкогенов, неправильной чрезмерной артикуляции типичных онкогенов или из-за недостаточной экспрессии или отключения генов-глушителей опухолей.Обычно для превращения типичной клетки в болезненную требуется изменение нескольких генов.
Молекулярно-генетическое тестирование — это совокупность стратегий, используемых для анализа биологических маркеров в геноме и протеоме — наследственного кода человека и того, как его клетки выражают свои гены как белки — путем применения молекулярной науки к медицинскому тестированию. Система используется для диагностики и мониторинга заболеваний, а также для выбора методов лечения, которые лучше всего подходят для отдельных пациентов. Изучая особенности пациента и его заболевания, молекулярная диагностика предлагает возможность индивидуального решения.
Эти тесты ценны в области терапевтических специализаций, включая инфекционные заболевания, онкологию, типирование антигена лейкоцитов человека, коагуляцию и фармакогеномику — генетическое предсказание того, какие лекарства будут работать лучше всего.
Молекулярная медицина — это широкая область, помогающая понять нормальное функционирование организма и патогенез болезней на молекулярном уровне с использованием физических, химических, биологических и медицинских методов с целью разработки молекулярных посредников для их коррекции.Молекулярная медицина — это применение молекулярной биологии и молекулярной генетики для понимания здоровья и болезней человека. Его цель — понять, как поддерживается здоровье, а также причины и механизмы болезней человека. Перспектива молекулярной медицины делает упор на клеточных и молекулярных явлениях и вмешательствах, а не на прежнем концептуальном и наблюдательном внимании к пациентам и их органам.
Клеточная медицина включает в себя широкий спектр биологических процедур
.
Педиатрическая генетика и геномная медицина
Генетика и геномная медицина
Теперь предлагает виртуальные посещения
Жизнь кажется совсем другой в эти трудные времена, но факультет педиатрии Вашингтонского университета готов позаботиться о потребностях вашего ребенка, как и мы всегда. С виртуальными посещениями вы можете увидеть своего врача, не посещая офис. Наши сотрудники проведут вас на каждом этапе процесса. Узнать больше: http: //physICAL.wustl.edu / virtualvisit
Отдел генетики и геномной медицины гордится тем, что предоставляет пациентам и их семьям быструю, всестороннюю и доброжелательную современную клиническую помощь. Мы обеспечиваем лечение пациентов в Детской больнице Сент-Луиса и Еврейской больнице Барнс в медицинском кампусе Вашингтонского университета. Детская больница Сент-Луиса признана одной из лучших детских больниц в Соединенных Штатах, а медицинская школа Вашингтонского университета неизменно считается одной из лучших медицинских школ страны.Мы активно участвуем в обучении генетике и геномной медицине студентов-медиков Вашингтонского университета, ординаторов и аспирантов в нашем медицинском кампусе, а также врачей и других поставщиков медицинских услуг в Вашингтонском университете и в большом сообществе Сент-Луиса.
Оказываем помощь детям и взрослым с различными медицинскими проблемами, в том числе
- Врожденные дефекты
- Нарушения при обследовании новорожденных
- Врожденные болезни обмена веществ
- Генетические синдромы
- Синдромы семейного рака
- Хромосомные аномалии
- Многие другие генетические нарушения
Заявление о миссии
Обеспечение превосходного ухода для всех, кто нуждается в профессиональных услугах в области клинической генетики. | |
Подготовка всех, кто получил образование в Отделе, к преуспеванию в области медицинской генетики. | |
Расширение базовых и прикладных знаний в области генетики. |
,
Магистр медицинской генетики и геномики

Прием заявок на осень 2020 открыт.
Крайний срок подачи заявок — 5 августа 2020 г. (или до заполнения программы)
Из-за текущих трудностей с планированием экзаменов GRE / MCAT и DAT эти тесты могут быть отправлены, если у вас уже есть результат, но не требуется подавать заявку. Пожалуйста, свяжитесь с нами, если у вас нет этих оценок, и мы проконсультируем вас и проведем вас через процесс подачи заявки.С любыми вопросами обращайтесь к Кристи Рокхолд по адресу [email protected] или доктору Карен Вайсбекер по адресу [email protected]. Спасибо!
Обзор программы
Центр генетики Хейворда предлагает 1-летнюю степень магистра медицинской генетики и геномики после получения степени бакалавра. Эта мультидисциплинарная программа дает выпускникам глубокое понимание быстро развивающейся области клинической генетики человека. Он предназначен для подготовки квалифицированных специалистов к карьере в области здравоохранения и предоставления образовательного опыта, который расширит возможности поступления в профессиональную аспирантуру, такую как медицинская школа или программы докторантуры.
- Большинство наших студентов подготовлены к медицинскому факультету, и, хотя это число меняется от года к году, по нашим оценкам, более 90% наших выпускников, которые подают заявления в медицинский институт или школу остеопатии, были приняты в последующие годы.
- Помимо медицинской школы, выпускники нашей программы также сделали другие карьеры, включая стоматологическую школу, программы PhD, магистерские программы по генетическому консультированию и работу с компаниями, занимающимися биомедицинскими технологиями.
- Учебная программа включает курсы, охватывающие тот же материал, что и первый год курса генетики Тулейнской медицинской школы и первый год курса медицинской биохимии.
- Мы предлагаем возможности клинического слежения в клиниках Tulane Genetics
Для запроса дополнительной информации о программе Masters, пожалуйста, обращайтесь:
Доктор Карен Вайсбекер
Директор отдела последипломного образования
Центр генетики Хейворда
Медицинский факультет Тулейнского университета
1430 Тулейн-авеню
Новый Орлеан, Луизиана 70112-2699
Телефон: 504988-6242
Электронная почта: [email protected]
или:
Кристи Рокхолд
Директор административной программы
Центр генетики Хейворда
Медицинский факультет Тулейнского университета
Телефон: 504 988-5101
Электронная почта: crockhol @ tulane.edu


Поставьте нам лайк на Facebook — Tulane Hayward Genetics Masters Program
 Следуйте за нами в Twitter: @Tulane_Genetics
Следуйте за нами в Twitter: @Tulane_Genetics
,