Жесткость воды что это такое
Проблемы водоподготовки в быту и на производстве решаются путем применения различных методик и специального оборудования. Ответ на вопрос, что такое жесткость в воде и как ее уменьшить до приемлемых величин — один из самых сложных и трудно решаемых даже при наличии доступных систем фильтрации. Вместе с тем высокое содержание растворимых солей негативно сказываются на состоянии здоровья человека, бытовых приборов и технологического оборудования.
Жесткость воды — это показатель качества, во многом определяющий ее физико-химические свойства и возможности применения. В предлагаемой статье рассматриваются причины этого явления, устанавливаются различия параметров жидкости в зависимости от концентрации солей. Также приводятся требования к жидкости и разбираются существующие бытовые и профессиональные методы ее умягчения.
Что такое жесткость воды
Оксид водорода (вода) — самая распространенная жидкость на земле, обладающая уникальными свойствами растворять в себе многие химические элементы и соединения. Понятие жесткости воды в определении трактуется как количественный показатель концентрации солей щелочноземельных и иных металлов. Преимущественно это соединения кальция и магния.
Термин общая жесткость воды возник в результате наблюдений за состоянием тканей после стирки. Особая структура материала, состоящего из отдельных нитей, способствует накоплению упомянутых солей металлов. При большом их содержании ткань, становится жесткой и грубой. Позже было замечено, что высокая концентрация таких соединений существенно снижает эффективность моющих средств.
Жесткость воды — это соли кальция и магния, образующие накипь на внутренних поверхностях нагревательных приборов и теплообменников. Это в свою очередь приводит к ухудшению эксплуатационных и экономических характеристик нагревательного оборудования. В отдельных случаях трубопроводы в буквальном смысле закупориваются, что делает невозможным их использование по назначению. Определить есть ли в воде жесткость можно даже в домашних условиях!
Основные причины образования жесткости воды
Фактически эта жидкость является универсальным растворителем, который при контакте с почвой и минералами насыщается содержащимися в ней веществами и химическими соединениями. Отвечая на вопрос о жесткости воды, и чем она обусловлена, необходимо выделить основные источники солей щелочноземельных металлов:
- Для подземных источников — это пласты известняка, сквозь которые просачивается жидкость.
- Для открытых водоемов и приповерхностных слоев — это геологические породы: природный гипс, доломит и другие.
- Ионы кальция и магния насыщают воду в результате химических реакции диоксида углерода и некоторых минералов.
- Микробиологические процессы в грунтах и на сельскохозяйственных угодьях в районах водосбора.
Помимо естественных причин повышенное содержание ионов жесткости в воды обусловлено также и техногенными. В составе стоков промышленных, строительных и коммунальных предприятий имеется большое количество примесей. В результате происходит вторичное загрязнение водоемов и водоносных слоев.
Естественные процессы химического выветривания горных пород и техногенные факторы определяют параметры жесткости воды питьевой или технической. Эти показатели неодинаковы для различных источников и постоянно изменяются:
- Повышаются в результате испарения влаги с открытых поверхностей водоемов.
- Снижаются при выпадении атмосферных осадков, таянии льдов и снега.
Значительное содержание извести в воде — это жесткость преимущественно естественного происхождения, характерная для подземных источников, в том числе и для артезианских скважин. Минерал вымывается из геологических пластов потоками жидкости при просачивании вглубь земной коры. Затем этот раствор через родники и ключи пополняет водный баланс открытых источников.
Происходит постоянный кругооборот, и жесткость воды в некоторой степени зависит от времени года. Весной в ходе таяния снегов и активных осадков он существенно уменьшается в другие периоды и, особенно при засухах — увеличивается.
Виды жесткости воды
Уровень содержания солей и их состав для разных источников водоснабжения как открытых, так и закрытых различаются и существенно. Возникает закономерный вопрос, а какова жесткость воды, и какой она может быть в зависимости от происхождения. Существует классификация по уровню насыщенности химическими веществами и соединениями, для удобства сведенная в таблицу:
Приведенная шкала наглядно показывает уровни жесткости воды, и в чем она измеряется в системах, принятых в разных государствах. Данная классификация отображает методические подходы к определению означенного показателя в соответствии с нормативными документами следующих стран:
- Россия. Государственный стандарт.
- Германия. Институт стандартизации — DIN.
- США. Агентства по охране окружающей среды Соединенных Штатов Америки — USERA.
Упомянутый градус жесткости воды — это единица измерения, принятая в западных странах. Этот показатель соответствует следующим значениям:
- В Германии (°dH). Одна часть CaO или 0,719 части MgO на 100 тыс. частей воды.
- В Британии (°e). 1 гран CaCO3 на один галлон жидкости.
- В США (ppm) и Франции (°TH). Одна часть CaCO3 на 100 тыс. частей воды.
При сравнительно невысоком уровне жесткости воды содержание ионов кальция в ней может достигать 70-80%, в тоже время насыщенность ионами магния редко превышает 50-60%. При увеличении уровня минерализации картина резко меняется: концентрация первых сильно уменьшается и редко доходит до 1 г/л; содержание же ионов магния часто превышает показатель 10 г/л. Такое соотношение особенно характерно для соленых озер, не имеющих стока.
Классификация вод осуществляется не только по уровню жесткости, но и с учетом ее гидрохимического состава. По данному признаку различают следующие разновидности:
- Общая.
- Временная (карбонатная).
- Постоянная (не карбонатная).
Для каждого типа характерно определенное соотношение содержания солей кальция, магния и других. Соответственно методы уменьшения жесткости воды зависят от ее вида, и состав оборудования для конкретного случая определяется с учетом реальных показателей. Рассмотрим этот вопрос подробнее.
Общая жесткость воды
Исследуемый показатель в значительной мере зависит от гидрохимического состава жидкости и уровня насыщения солями кальция и магния. Общая жесткость — это свойство воды, определяемое суммарным содержанием гидрокарбонатов и других соединений названных элементов. Данная характеристика имеет две составляющие:
- Карбонатная (временная). Связана с наличием в жидкости гидрокарбонатов кальция (Ca2+) и магния (Mg2+), которые при нагревании и кипячении образуют CaCO3 и Mg(OH)2 с выделением углекислого газа (CO2).
- Некарбонатная (постоянная). Определяется присутствием фосфатов, хлоридов, сульфатов, силикатов и нитратов этих щелочноземельных металлов.
Перечисленные соли, определяющие общую жесткость воды, при кипячении не разлагаются и их удаление из жидкости требует иных методов. Для численного выражения этого показателя используют специальную физическую единицу 1 ммоль-экв./л, которая соответствует содержанию 20,04 мг/л катионов кальция либо 12,16 мг/л катионов магния.
Общая жесткость подземных вод (в некоторых регионах), а также морских и океанских может достигать 80 и даже 100 ммоль-экв/л, что делает их непригодными для использования. В тоже время в реках и озерах, находящихся в таежных районах данный показатель находится на уровне от 0,1 до 0,2 ммоль-экв/л. Такой водой практически невозможно смыть мыльный раствор.
Временная жесткость (карбонатная)
Природная вода содержит значительное количество катионов щелочноземельных металлов. Временная (магниевая и кальциевая) жесткость воды — это показатель присутствия в жидкости гидрокарбонатов названных химических элементов. При нагревании растворимость этих соединений (при уровне pH превышающем 8,3 единицы) существенно уменьшается, и они переходят в следующие формы:
- осадок хлопьевидный;
- беловатая пленка на поверхности;
- кристаллическая накипь.
Временная жесткость воды по кальцию и магнию при этом полностью устраняется — отсюда собственно и название. Помимо кипячения уменьшить означенный показатель возможно используя ионообменные методы и технологии обратного осмоса.
Постоянная жесткость (некарбонатная) воды
Помимо гидрокарбонатов кальция и магния в источниках водоснабжения присутствуют в значительных количествах соли азотной, серной и соляной кислоты. Под некарбонатной жесткостью воды подразумевается суммарное содержание этих химических соединений. Последние при нагревании остаются в растворенном состоянии и не выпадают в осадок.
Некарбонатная жесткость воды именно поэтому и называется постоянной, а для ее устранения необходимо специальное оборудование. Существенно уменьшить концентрацию этих растворимых соединений возможно при использовании ионообменных технологий и деминерализации. Особенно высока эффективность у современных систем умягчения.
Действующие нормативы жесткости воды
Нормы жесткости, характеризующие качество источников водоснабжения, регламентируются во всех развитых странах. В Российской Федерации принят ГОСТ 31954-2012, которым устанавливаются предельные значения общей жесткости воды и определяются способы ее вычисления. Этим документов утверждены два метода: комплексонометрический — основной и атомной спектрометрии — арбитражный.
Жесткость общая воды в части гигиенических норм устанавливается требованиями СанПиН 2.1.4.1075-01, утвержденным Постановление от 26.09.2001 года. Суммарный показатель содержания солей щелочноземельных металлов не должен превышать предельно-допустимых концентраций, которые определены в размере 7,0 и 10,0 мг-экв./л. Второе значение может быть установлено только по решению главного санитарного врача с учетом используемой технологии водоподготовки для конкретного населенного пункта.
Расчет жесткости воды
При определении общей жесткости воды допускается применение вычислительных методов. Этот показатель измеряется в ммоль/дм3 или моль/м3 и описывается следующей формулой:
ЖО = [Ca2+] + [Mg2+] = ЖК + ЖНК;
Данное уравнение позволяет вычислить среднюю жесткость воды, в ней приняты следующие обозначения:
ЖО — общая.
ЖК — карбонатная (временная).
ЖНК — некарбонатная (постоянная).
Для того чтобы рассчитать общую жесткость воды необходимо знать молярную масса катионов кальция и магния, а также анионов сернистой кислоты. Результаты вычислений могут быть использованы для определения наиболее подходящего метода ее очистки. Подобные расчеты проводятся специалистами профильных лабораторий на основании опытных данных.
Методы определения уровня жесткости воды
Как определить жесткость воды? Точная оценка количественных параметров содержания солей производится специализированными лабораториями. В соответствии с ГОСТ 31954-2012 общая жесткость воды определяется комплексонометрическим методом в такой последовательности:
- Проба разделяется на две равные части.
- В химическую колбу наливают 100 мл исследуемой воды, добавляют к нему 5 мл буферного раствора и сухой индикаторной смеси в количестве 0,06-0,10 г. Получившийся состав титруется трилоном Б.
- Аналогичные действия выполняются в отношении второй части пробы в другой лабораторной посуде. Добавление трилона Б осуществляется в два приема: сначала — на 0,5 см3 меньше, чем при исследовании первого образца. После тщательного перемешивания вводится остаток.
Обработка результатов, полученных с использованием описанного метода определения общей жесткости воды, выполняется по следующей формуле:
Ж = M•K•Vтp/Vnp,
где M — коэффициент пересчета;
K — коэффициент поправочный;
Vтp — объем трилона Б, использованного для титрования;
Vnp — количество исследуемой воды из пробы.
Результат испытаний согласно данному методу определения общей жесткости в питьевой воде, а также технической, вычисляется как среднеарифметическое от двух полученных значений. Это позволяет минимизировать погрешность расчетов.
Бытовые способы умягчения воды
Высокая соленость и жесткость воды, используемой в пищу и в хозяйственно-бытовых целях, может принести вред здоровью и привести к выходу из строя бытовой техники. В домашних условиях уменьшить этот показатель можно путем термической и химической обработки исходной жидкости.
Устранимая жесткость воды — карбонатная (временная) снижается при длительном кипячении. В процессе нагрева гидрокарбонатные соединения кальция и магния распадаются и переходят в твердое состояние. Они образуют накипь на стенках посуды, хлопьевидный осадок и поверхностный налет. Последние легко удаляются фильтрованием или отстаиванием.
Химическая обработка в целях снижения жесткости исходной воды выполняется при помощи извести и соды. Первый реагент обеспечивает умягчение жидкости с незначительным содержанием некарбонатных и высокой насыщенностью карбонатными соединениями. Для повышения эффективности данного метода дополнительно применяются реагенты коагулянты.
Комбинирование извести и пищевой соды позволяет уменьшить общую жесткость речной или колодезной воды до значений 1,4-1,8 мг экв./л. Химическая обработка обеспечивает улучшение качества жидкости по данному показателю, но требует очень точной дозировки реагентов. Кроме того она непригодна для приготовления пищи и питья.
Профессиональные методы снижения жесткости воды
Качественное умягчение исходной воды до требуемого уровня возможно только при использовании специального оборудования — фильтров от жесткости воды. Довести показатели жесткости до соответствия требованиям упомянутого СанПиН и «ГОСТ вода питьевая» позволяют следующие технические устройства:
- Фильтры умягчения.
- Ионообменные фильтры.
- Системы обратного осмоса.
При выборе установки для снижения жесткости воды, прибором для ее определения устанавливают точный гидрохимический состав и количественное содержание солей. Оборудование подбирается по результатам испытаний и с учетом требований заказчика к качеству обработанной воды.
Фильтры умягчения
Процесс уменьшения общей жесткости воды должен быть достаточно эффективным и недорогим. В настоящее время основным способом умягчения является метод натрий-катионирования (фильтры умягчения), который применяется и в быту, и в промышленных масштабах. Поток воды пропускается через ионообменные колонны, где происходит замещение кальция и магния катионами натрия. На поверхности полимерных смол происходят следующие химические реакции:
Ca2+ + 2RNa = 2Na+ + R2Ca
Mg2+ + 2RNa = 2Na+ + R2Mg
В результате общая жесткость доводится до уровня питьевой воды по ГОСТу, что делает возможным ее применение для приготовления пищи и хозяйственно-бытовых нужд.
Такие фильтрующие колонны применяются в составе многоступенчатых систем, в которых вода сначала очищается от механических примесей и железа. Это позволяет повысить ресурс основных картриджей, который естественным образом уменьшается в процессе расходования ионов натрия и накопления ионов жесткости. Для восстановления свойств ионообменных смол в системе предусмотрены баки с раствором поваренной соли, клапаны и блоки управления.
Когда датчик фиксирует повышение жесткости воды в ppm, подача ее перекрывается и производится обратная промывка содержимого колонны солевым раствором. После восстановления характеристик полимерных гранул, подача реагента прекращается. Открывается клапан и возобновляется процесс умягчения.
Управление работой такого фильтра, обеспечивающего уменьшение общей жесткости природной воды, в зависимости от комплектности осуществляется в автоматическом или в ручном режиме. В первом варианте используются электронные датчики и электроклапаны. Во втором случае переключение установки в режим регенерации выполняется человеком по истечении определенного периода времени.
Ионообменные фильтры
Данный метод умягчения по принципу действия в значительной мере аналогичен описанному выше. Замещение ионов, обуславливающих жесткость воды, в них происходит с помощью многокомпонентных смол типа Ecomix или Ecotar. В состав этих фильтрующих загрузок входят следующие материалы:
- Смола инертная обеспечивает обезжелезивание воды.
- FerroSorb удаляет соединения железа и марганца.
- HumiSorb нейтрализация органических примесей.
- Смола ионообменная для умягчения воды.
- Песок кварцевый в виде подложки, обеспечивающей равномерное распределение потоков жидкости.
Применение многокомпонентных составов для фильтрующих установок позволяет снизить общую жесткость воды за счет реакции замещения катионов кальция и магния. Данная технология более универсальна в сравнении с фильтрами умягчения, однако и менее эффективна. При этом финансовые затраты на ее приобретение и содержание выше нежели у специализированных элементов.
Обратный осмос
Использование полупроницаемых мембран обеспечивает высочайший уровень очистки жидкости от всех видов примесей. В современных системах обратного осмоса показатели общей жесткости воды после кондиционирования на мембранах типа DRO-4040 или DRO-8040 снижаются более чем на порядок. Такие установки применяются для опреснения соленых воды (океанских, морских, озерных и подземных).
Мембраны имеют пористую структур, пропускающую только молекулы воды и задерживающую соединения кальция и магния (гидрокарбонатные и соли кислот). В результате происходит снижение общей жесткости воды до значений, делающих возможным ее применение в фармацевтике и микроэлектронике. Пермеат практически не содержит микроэлементов и нуждается в минерализации для питья и приготовления пищи.
Такие показатели, существенно превосходящие ГОСТ для питьевой воды по общей жесткости, явно избыточны. С учетом высоких начальных затрат на приобретение, монтаж и последующее обслуживание использовать установки обратного осмоса в быту экономически невыгодно. Гораздо эффективнее для таких целей применять традиционные фильтры умягчения.
Что такое общая жесткость воды
Получив представление о жесткости воды, и как она влияет на организм, а также на бытовую технику и другое оборудование, приходим к выводу о необходимости ее нормализации. Кустарные методы (кипячение или химобработка) не обеспечивают надлежащего качества воды. Кардинальное решение проблемы возможно только при использовании современных фильтрационных установок.
Компания Diasel Enginereeng предлагает высокоэффективные системы водоподготовки: фильтры умягчения и ионообменные, а также обратноосмотические. Мы предоставляем полный комплекс услуг по проектированию установок, подбору, монтажу и запуску оборудования. Наши специалисты обеспечивают их сервисное и гарантийное обслуживание. Перейти в раздел «Контакты».
Жесткость воды что это такое
Жесткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворенных солей щелочноземельных металлов, главным образом, кальция и магния (так называемых «солей жесткости»). Вода – сложное природное вещество, в состав которого входит целый набор микроэлементов. В том или ином виде вода содержится во всех живых организмах. Что подразумевается под понятием жесткость, и что определяет данный показатель?
Подробнее про жесткость воды
Жесткость – это свойство воды, которое определяет ее потребительские качества и имеет важное хозяйственное значение. В процессе кипячения жесткая жидкость образует накипь на стенках и внутренних деталях нагревательных приборов, что вызывает ухудшение теплотехнических характеристик бытовой техники. Не особенно подходит она и для стирки, поскольку способствует снижению очищающих характеристик моющих средств и увеличивает их расход.
| Градусы dH | Характер воды | Жесткость в мг. х экв/л. | Эквивалент в mg/L |
| 23 — 34° | Очень жесткая | выше 12 мг х экв/л | 320 — 530 ppm |
| 13 — 22° | Жесткая | 8 – 12 мг х экв/л | 210 — 320 ppm |
| 9 — 12° | Средней жесткости | 4 – 8 мг х экв/л | 140 — 210 ppm |
| 5 — 8° | Мягкая | 1,5 – 4 мг х экв/л | 70 — 140 ppm |
| 0 — 4° | Очень мягкая | До 1,5 мг х экв/л | 0 — 70 ppm |
Откуда берется высокая жесткость? Ее определяет наличие солей магния и кальция – химических компонентов, выполняющих роль активных регуляторов различных химических процессов в окружающей среде. Естественно, что жидкость, которая берется из разных водоемов, может иметь ту или иную степень жесткости. При этом река, озеро и любой другой источник пополняются из подземных источников, протекающих в известняковых пластах. Проходя через них, вода обогащается солями жесткости, а значит, будет жесткой. Для сравнения – данный показатель у поверхностных вод всегда заметно ниже, чем у подземных. Жесткость воды в природных источниках постоянно изменяется. Максимальных отметок она достигает зимой, а минимальных – весной, во время таяния снегов.
Таким образом, жесткой является та вода, которая содержит соли магния и кальция в больших количествах. Кстати, магниевые соли растворяются хуже кальциевых, и жидкость с их высоким содержанием имеет выраженный горький вкус.
Шкала жесткости воды
Выделяются следующие виды жесткости:
- Общая – определяется как суммарная концентрация ионов магния и кальция.
- Карбонатная – зависит от наличия в воде карбонатов, гидрокарбонатов кальция и магния. Практически полностью устраняется в ходе кипячения, поэтому второе название карбонатной жесткости – временная. В процессе нагрева гидрокарбонаты распадаются – образуется угольная кислота, а карбонаты кальция, гидроксиды магния выпадают в виде осадка.
- Некарбонатная – обусловлена присутствием магниевых и кальциевых кислотных солей. При кипячении не устраняется (то есть является постоянной).
Общая жесткость измеряется в GH. GH показывает суммарное содержание щелочноземельных металлов в виде ионов. Для примера – в воде, значение GH которой близкое к нулю, аквариумные рыбки не живут, употреблять ее в пищевых целях также не рекомендуется.
В каких единицах измеряется жесткость
В мире для измерения показателей жесткости используются разные значения. В России Госстандарт установил следующий показатель – моль на кубический метр. Числовое значение жесткости, которое выражается в молях на кубический метр, равняется числовому значению жесткости в миллиграмм-эквивалентах на литр. На западе используют немецкий (d°, dH), французский (f°), американский (ppm CaCO3) градусы.
Как повысить и понизить жесткость воды в аквариуме. Определение временной, или карбонатной жесткости
Чтобы создать комфортные условия для жизни аквариумных рыбок, важно использовать воду оптимальной жесткости, с заданным кислотно-щелочным балансом. Чтобы повысить жесткость воды, используют известняк и мрамор. Чем мягче вода, тем быстрее она повысит жесткость. Другой способ – химический, с применением хлористого кальция и магнезии. Максимальный эффект достигается при использовании обоих препаратов одновременно.
Чтобы уменьшить жесткость, воду нужно прокипятить. Как долго это следует делать? Учтите, что для снижения жесткости вдвое, кипятить воду нужно минимум в течение получаса. Другой способ – вымораживание. Воду наливают в пластиковый контейнер и помещают в морозилку. Затем лед растапливают, а полученную воду используются в пищевых или любых других целях.
Если объемы воды большие, проще будет использовать специальное оборудование. Широкое распространение в быту в последние годы получили установки обратного осмоса. Для расчета необходимого объема водопроводной воды используйте формулу – вычитание объема воды, получаемой из водопровода, из объема с заданной жесткостью, который нужно получить.
Часто методы умягчения используют комбинированно. Например, одну часть солей жесткости убирают реагентным способом, а другую с помощью катионного обмена. Приведем формулы содово-известкового способа умягчения:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
В итоге Mg(OH)2 коагулирует, выпадая в осадок. Затем, в целях устранения некарбонатной жесткости, вводится Na2CO3. Последующие химические реакции:
Na2CO3 + CaSO4 = CaCO3 + Na2SO4 и Na2CO3 + СаС12 = СаСО3 + 2NaCl.
В итоге образуется углекислый кальций, выпадающий затем в осадок. Реагенты вводят в разные зоны:
- хлор – во всасывающие трубопроводы;
- коагулянт – в трубопровод перед смесителем либо непосредственно в смеситель;
- известь – вместе с коагулянтом;
- уголь активированный – перед фильтрами;
- хлор и аммиак – в фильтрованную воду.
Опреснение, обессоливание, удаление растворенных газов, железа, стабилизация – это специальные способы очистки. Так если для снижения жесткости используются методы катионирования или ионного обмена, речь идет об обессоливании. Вода, которая получается на выходе, не содержит ни анионов, ни катионов солей.
Как измерить жесткость
Для оценки показателей жесткости воды используются следующие способы:
- Комплексонометрическое титрование трилоном Б. Метод сложный и самый точный.
- Покупные тесты. Не на 100% точные, зато простые и недорогие.
- Измерение электропроводности. Используйте кондуктометр.
- С помощью ионометра и ионоселективных электродов.
- С применением методики титрования соляной кислотой проб воды. Сложный и не очень точный метод. То же самое можно сказать о тестах с применение хозяйственного мыла.
Под титрованием подразумевается добавление в воду реагента требуемой концентрации. Концентрация солей жесткости определяется в зависимости от реакции реагента с водой. Приготовить реактив просто – достаточно смешать кислоту с дистиллированной водой в заданных пропорциях. Готовый раствор опасности не представляет.
Проще всего использовать готовые тексты. Для этого 5 мл воды наливается в стаканчик, затем в жидкость по каплям добавляется содержимое теста, после каждой капли вода перемешивается. Делать так нужно до тех пор, пока цвет не станет зеленым вместо розового.
Влияние жесткости воды, нормативные требования и рекомендации
Какую воду можно употреблять для приготовления пищи и питья? Требования относительно жесткости жидкости зависят от условий конкретной местности. Учтите, что слишком жесткая вода имеет горький вкус и негативно влияет на работу органов пищеварения. ВОЗ конкретные цифры не называет, хотя исследований на тему связи качества воды с заболеваниями сердца, сосудов и других органов организма проводились неоднократно. Слишком мягкая вода – это тоже плохо, поскольку она нарушает водно-солевой баланс. Жидкость с жесткостью от 4 мг-экв/ чревата – главная причина образования накипи на внутренних деталях отопительных систем. Вредна она и для кожи, волос.
Вместо заключения
Жесткость – важный параметр воды, который зависит от количества и типа растворенных в ней минеральных веществ. Смягчение следует делать только после предварительного анализа. Почему? Потому что не все меды смягчения снижают содержание минеральных веществ – они могут просто превращать соли жесткости в соли, которые никак не влияют на рассматриваемый показатель.
Что такое жесткость воды: уровень и методы определения
Жесткость – параметр качества воды
Жесткость питьевой воды – одна из качественных характеристик воды, которое обуславливается наличием в воде солей двух щелочноземельных металлов — кальция и магния. Жесткость имеет значение для оценки качества любой используемой воды, технической, питьевой и воды, используемой для нужд промышленных предприятий с заданными характеристиками.
Наибольшее влияние на уровень жесткости воды оказывает количество катионов кальция, несколько в меньшей степени – магния. Катионы стронция, железа и марганца также оказывают влияние на жесткость воды, однако их вклад в общую жесткость воды так мало, что на практике обычно пренебрегают их значениями.
Общая жесткость определяется суммой временной и постоянной жесткостью воды.
Постоянная жесткость воды – кальциевые и магниевые соли соляной, серной, азотной кислот, т.е. сильных кислот. Такие соли жесткости в воде при кипячении не выпадают в осадок и не кристаллизуются в виде накипи.
Временная жесткость воды – показатель, наличия в воде карбонатов и гидрокарбонатов кальция и магния, которые при кипячении и показателях рН больше 8,3, практически полностью выпадают в хлопьевидный осадок, кристаллизуются в виде накипи или образуют пленку на поверхности воды.
Как соли кальция и магния попадают в природную воду, ведь вода, выпадающая в виде осадков, как и талая вода, не содержат солей?
Это происходит следующим образом: вода, напитывается солями, содержащимися в известняках, гипсах и доломитах залегающих в толщах земли.
Это основной источник этих солей. Кроме этого, выветривание горных пород, также может оказывать влияние на карбонатную жесткости воды.
Согласно методам определения жесткости воды по гидрохимии считается:
- 0-4 мг-экв./л – мягкая вода
- 4-8 мг-экв./л – средней жесткости
- 8-12 мг-экв./л – жесткая вода
- Больше 12 мг-экв./л – очень жесткая
Это касается оценки общей минерализации воды, но для питьевой воды российский СанПиН определяет предельно допустимые концентрации 0-7 мг-экв/л.
Специалисты в области фильтрации условно делят жесткость питьевой воды так:
- 0-1,5 мг-экв/л – мягкая вода
- 1,5-2 мг-экв/л – оптимальная питьевая вода
- 2-5 мг-экв/л – жесткая вода
- 5-7 мг-экв/л – сверхжесткая вода
- Больше 7 мг-экв./л – не питьевая вода, за пределами рекомендованных значений.
Можно разделить природную воду на поверхностную и подземную.
Поверхностная вода обычно имеет меньшую жесткость, поскольку она разбавляется в значительной степени осадками и талыми водами. Этим объясняется и факт сезонных изменений показателей общей жесткости для поверхностных вод.
Состав подземных вод более постоянен, и обычно имеет большие значения, чем у поверхностной воды, по общей жесткости.
Питьевая вода должна иметь оптимальный состав по количеству солей жесткости.
Слишком много солей – риск возникновения мочекаменной болезни, заболеваний костей, суставов. Слишком мало солей – соли вымываются из организма, кости приобретают большую ломкость, возрастает риск заболеваний суставов, сосудов.
По мнению некоторых исследователей, в регионах с пониженным уровнем жесткости воды, также возрастает риск сердечнососудистых заболеваний. Это подтверждается статистикой по странам Европы и Северной Америке, исследованиям в российских регионах с разными средними показателями по жесткости воды.
Также жесткая вода образует накипь, что приводит к уменьшению сроков службы бытовой технике, преждевременному износу водонагревательного оборудования, портит сантехническое оборудование.
Вода, уровень жесткости которой меньше двух мг-экв/л способна сильнее, чем более жесткая вода оказывать на водопроводные трубы коррозийное воздействие, поскольку имеет более низкую щелочность.
Поэтому, в ряде случаев, особенно в теплоэнергетике, иногда приходится проводить дозирование карбонатной жесткости воды с целью достижения оптимального соотношения между коррозионной активностью воды, ее водородному показателю и содержанию кальция и магния.
В настоящее время ряд специалистов, ссылающиеся на данные ВОЗ, утверждают, что имеющаяся статистика не позволяет однозначно считать мягкую и жесткую воду опасной для здоровья человека. И все же имеющиеся данные подтверждают зависимость водно-солевого баланса в организме человека от этих факторов, а отсутствие нормативной доказательной базы на уровне Всемирной Организации Здравоохранения, не причина закрывать глаза на качество питьевой воды по количественным показателям солей жесткости — солей кальция и магния.
Закажите консультацию специалиста компании Гейзер
Остались вопросы? Мы всегда готовы предоставить консультацию по всем вопросам очистки воды!
Жесткость воды как определить в домашних условиях
Неочищенная вода из водопровода или природных источников имеет повышенную степень жесткости. Этот параметр напрямую воздействует на физико-химические и органолептические свойства жидкости. Вода с высоким содержанием солей жесткости ухудшает состояние кожи и волос, нарушает работу сальных желез, сердца, пищеварительного тракта. Она приводит к поломкам бытовой техники, оставляет следы на сантехнике, делает жестким белье после стирки. Можно предупредить эти неприятности заранее, понизив жесткость воды в домашних условиях.
Понятие и разновидности жесткости воды
Немногие знают, что такое жесткость воды и как от нее можно избавиться в домашних условиях. Под жесткостью понимают количество содержащихся в воде солей Ca и Mg. Чем выше их концентрация, тем жестче жидкость. Различают несколько видов жесткости:
- Карбонатная (временная). Зависит от содержания в воде солей угольной кислоты. При кипячении химические соединения распадаются и образуют нерастворимый осадок.
- Некарбонатная (постоянная). Обусловлена присутствием в воде солей кальция, магния, бария или стронция на основе сильных кислот. Карбонатная жесткость остается после кипячения. Ее расчет выполняют на основании солей кальция и магния, пренебрегая долей бария и стронция ввиду их малого содержания.
- Общая. Под ней понимают суммарное содержание всех солей жесткости.
Для измерения концентрации солей кальция и магния в РФ используется стандартная единица измерения — градус жесткости (°Ж). В соответствие с ГОСТ 31865-12, он численно равен содержанию ½ миллимоля Ca или Mg на 1 литр (1 °Ж = 1 мг-экв/л).
Кальций и магний участвуют во многих природных химических процессах, поэтому их соли присутствуют в естественном виде в воде из разных водоемов. По степени жесткости вода бывает:
- мягкая — не превышает 2 °Ж;
- средней жесткости — от 2 до 8 °Ж;
- жесткая — более 8 до 12 °Ж;
- очень жесткая — свыше 12 °Ж.
Обычно, даже по визуальным признакам можно узнать жесткость воды домашних условиях. В природе мягкую воду можно найти в болотистой местности, на торфяниках. Вода средней жесткости встречается в разных регионах, такие показатели обычно у воды из скважин и колодцев. Жесткая присутствует на территориях с повышенным содержанием химических солей, при наличии различных загрязнителей. Она требует тщательной очистки. Сверхжесткая вода встречается вблизи горных пещер и шахт. Без обработки ее нельзя использовать для питья.
Как определить жесткость воды в домашних условиях
Чтобы эффективно умягчить воду из водопроводной системы или другого источника, нужно правильно измерить уровень ее жесткости. Это позволит грамотно выбрать метод смягчения, корректно подобрать оборудование (если потребуется).
Для точного определения состава исходной воды нужно отправить пробы на лабораторные исследования. Но если высокая точность не требуется, можно провести измерения самостоятельно. Для этого необходимо знать, чем определить жесткость воды в домашних условиях. Рассмотрим основные способы диагностики:
- Тест-полоски. Это экспресс-метод измерить жесткость воды дома, при котором бумажная полоска с нанесенным реагентом опускается в жидкость. Соли жесткости вступают в химическую реакцию, происходит изменение цвета тестера: чем выше концентрация, тем ярче оттенок. Тест-полоски продаются в зоомагазинах, магазинах бытовой техники.
- С использованием зеркала — еще один способ проверить жесткость воды в домашних условиях. На стеклянную поверхность наносятся несколько капель воды. После полного испарения жидкости нужно проанализировать оставшийся на стекле осадок. Метод предполагает использование сырой и кипяченной воды, соответственно, для нахождения общей и временной жесткости. Чем меньше осадок, тем мягче вода.
- При помощи мыла. Повышенное содержание солей ухудшает мылкость хозяйственного мыла. Это свойство можно использовать, чтобы достаточно точно проверить жесткость воды домашних условиях. Нужно измельчить 1 г мыла и аккуратно, не взбивая пену, растворить его в небольшом объеме нагретой дистиллированной воды. Высота уровня жидкости зависит от жирности мыла: для 60% надо налить 6 см; для 72% — 7 см. При этом, в каждом сантиметре раствора будет содержаться количество мыла, достаточное для связывания всех солей жесткости в 1 л воды при их концентрации 1°dH (немецкая единица измерения). Затем в банку наливают 0,5 л исследуемой воды. Сюда же добавляется мыльный раствор и перемешиваются до образования белой пены — она свидетельствует о связывании мылом солей жесткости. Замерив уровень оставшейся жидкости, можно найти искомую жесткость. Каждый сантиметр влитого мыльного раствора свяжет в 0,5 л воды количество солей жесткости в 2 °dH. Если до образования пены пришлось влить 3 см раствора, значит жесткость составляет 6 °dН.
- По накипи на чайнике. При кипячении жесткой воды на внутренних стенках прибора появляется несмываемый плотный налет. Этот метод требует достаточно много времени — вода с содержанием солей более 10 °Ж оставит заметный слой накипи примерно за месяц.
- По разводам на сантехнике. Даже без кипячения жесткая вода приводит к появлению известковых отложений. Она забивает сетки кранов, лейку, резьбу на разъемных соединениях.
- С помощью TDS-метра. Он измеряет электропроводность воды, на основании чего высчитывается жесткость. Способ достаточно сложный, он требует наличия опыта. К тому же, на электропроводность влияет общее содержание солей в воде, а не только кальция и магния.
Также в домашних условиях можно определить жесткость по органолептическим показателям. Вода с высоким уровнем минерализации разительно отличается по вкусу от чистой. Наличие солей магния придает ей характерный горьковатый привкус. Для оценки водопроводной воды можно провести эксперимент: приобрести воду разной степени жесткости и сравнить ее по вкусу.
Бытовые способы умягчения — как понизить жесткость воды в домашних условиях
Чтобы умягчить воду собственными силами, можно использовать такие варианты:
- Отстаивание. При отстаивании воды в течение минимум 24 часов содержащиеся в ней карбонаты частично выпадают в нерастворимый осадок. Метод используется для незначительного смягчения.
- Кипячение — самый простой способ уменьшить жесткость воды в домашних условиях. Под воздействием высоких температур происходит разрушение ионных связей в соединениях, что приводит к высвобождению элементов и выпадению осадка. Способ эффективен для снижения временной жесткости.
- Замораживание. Очищаемую жидкость помещают в морозильную камеру. Чистая вода застывает первой, а остаток содержит концентрированный жесткий раствор — его сливают. Талая вода не изменяется по структуре, она подходит для приготовления пищи, полива растений.
- Обработка пищевыми (химическими) реагентами. Здесь применяются пищевая сода, кальцинированная сода, лимонная и уксусная кислота, синтетические таблетирование реагенты. Так умягчают воду в домашних условиях для бытового использования и хозяйственных нужд (стирки, мытья посуды, уборки).
- Торфование. Для снижения жесткости воды используется самодельный фильтр из завернутого в ткань торфа. Его можно использовать для нескольких циклов домашней очистки.
Промышленное и бытовое удаление солей жесткости от компании Диасел
Для глубокого умягчения используется специализированное водоочистительное оборудование:
- Фильтры умягчения — различают картриджные, реагентные, электромагнитные. Для домашнего использования наиболее востребованы кувшинные фильтры со сменными кассетами. Фильтрация является основным способом смягчения воды для бытовых нужд.
- Ионнообменные фильтры — они эффективно удаляют соли жесткости, железо. В их состав входят многокомпонентные смолы (Экотар, Экомикс) — при прохождении через них в воде происходит замена ионов кальция и магния на более нейтральные элементы.
- Обратный осмос — установки с фильтрующими мембранами для комплексной очистки и смягчения воды.
Умягчение- это обязательный этап водоподготовки, улучшающий вкусовые качества жесткой воды и делающий ее безопасной для бытовых приборов. В домашних условиях устранить жесткость можно лишь частично, для получения воды высокого качества потребуется профессиональные системы фильтрации. Купить оборудования для умягчения воды можно в нашей компании. Для правильного выбора перед оформлением заказа проконсультируйтесь с нашими менеджерами. Выберите удобный способ для связи в разделе «Контакты».
Заявка на подбор оборудования
Жёсткость воды — единицы измерения, методы устранения и последствия для здоровья
На чтение 8 мин.
Обновлено
 Обычная вода состоит не только из атомов водорода и кислорода, в ней так же присутствует большое количество различных примесей. Именно наличие примесей определяет жесткость воды, а единицы измерения (°Ж – градус жёсткости) показывает, насколько этот показатель превышает допустимые нормы.
Обычная вода состоит не только из атомов водорода и кислорода, в ней так же присутствует большое количество различных примесей. Именно наличие примесей определяет жесткость воды, а единицы измерения (°Ж – градус жёсткости) показывает, насколько этот показатель превышает допустимые нормы.
Жёсткость воды требуется определять не только инженерам, которые занимаются прокладкой коммуникаций, но и обычной людям в быту. Если мы используем электрический чайник или стиральную машину с функцией нагрева воды, то все это может выйти из строя, если данный показатель будет слишком высок. Даже хорошо растворить мыло в такой воде у вас вряд ли получится.
О том, как определить уровень жесткости водопроводной воды, а также о методах борьбы с большим содержанием примесей будет подробно рассказано в данной статье.
Жёсткая и мягкая вода – в чём разница
На количество соли в воде влияет наличия растворённых в ней элементов кальция и магния. Значительно повысить этот показатель может также наличие гидрата железа, содержание которого в артезианских водах бывает избыточным.
В том случае, когда таких примесей содержится незначительное количество, её называют “мягкой”. Этот показатель обычно разделяется на 3 категории:
- Мягкая.
- Средняя.
- Жёсткая.
 Мягкая – это дождевая или полученная в результате перегонки жидкость. В такой воде практически отсутствуют минеральные примеси.
Мягкая – это дождевая или полученная в результате перегонки жидкость. В такой воде практически отсутствуют минеральные примеси.
В большинстве случаев она может получиться и в результате длительного кипячения или добавления специальных химических реагентов.
Средняя – встречается наиболее часто в водопроводных системах, а также в родниковой и артезианской воде.
Жёсткая – к данной категории относится морская, океанская, а также вода вытекающая из пластов породы богатой минеральными отложениями. В ней может быть растворено большое количество солей. Если брать в процентном соотношении, то соленость может достигать до 33% от общего объема.
Рассмотрим разновидности жёсткости
Этот показатель принято разделять на следующие категории.
- Постоянная – является неизменным показателем, который зависит от содержания сульфатов и хлоридов.
- Временная – обусловлена содержанием бикарбонатов кальция и магния. Название этот вид жёсткости получил за способность практически полностью нейтрализоваться в результате кипячения.
- Жёсткость общая – получается в результате сложения показателей постоянной и временной.
Для того чтобы точно определить этот показатель, необходимо знать какими единицами измерения это можно сделать.
Единицы измерения жёсткости
Для правильного подсчёта уровня жёсткости необходимо определить концентрацию катионов кальция и магния. В настоящее время этот показатель определяется в следующих единицах измерения:
- Моль/м3 (моль на кубический метр) – применялся в России до 2014 г.
- °Ж (градус жёсткости) – данная единица измерения используется в России с 2014 г.
- dH (немецкий градус) – единица измерения используется в странах Европы.
- fo (французский градус) – также применяется в европейский странах.
- ppm CaCO3 (американский градус) – единица измерения используется в североамериканских штатах.
Следует отметить, что в нашей стране выражение общей жёсткости моль/м3 стало использоваться только с 1952 года. До этого времени расчёты осуществлялись в градусах, которые были равны современному немецкому градусу.
С 2014 года в России действует международный стандарт подсчёта жёсткости, который выражается в градусах (°Ж). Один градус равен 1/2 миллимоля на литр жидкости, поэтому подсчитать уровень концентрации вещества в жидкости не составит большого труда.
Причины появления жёсткости воды
 При круговороте воды в природе жидкость превращается в пар и поднимается в верхние слои атмосферы. После конденсации она выпадает в виде осадков и не содержит примесей влияющих на жёсткость, но проходя через слой земной коры, жидкость растворяет различные породы, в которых содержатся калий и магний. Насыщаясь этими элементами вода увеличивает свою жёсткость. В море она всегда жёсткая по причине большой концентрации хлорида натрия.
При круговороте воды в природе жидкость превращается в пар и поднимается в верхние слои атмосферы. После конденсации она выпадает в виде осадков и не содержит примесей влияющих на жёсткость, но проходя через слой земной коры, жидкость растворяет различные породы, в которых содержатся калий и магний. Насыщаясь этими элементами вода увеличивает свою жёсткость. В море она всегда жёсткая по причине большой концентрации хлорида натрия.
При необходимости снизить концентрацию ионов калия и магния, можно применить различные методы уменьшения количества солевых примесей.
Методы устранения жёсткости
Для борьбы с чрезмерным содержанием солей применяются следующие методы:
- Кипячение – полностью устраняет временную жёсткость. Данный процесс сопровождается обильным выпадением осадка на дне и стенках резервуара, где происходит кипячение.

- Химическим путём – уменьшить количество солей можно с помощью гашённой извести. Если к извести будет добавлена сода, то можно избавиться и от постоянной жёсткости
- Заморозка – данный метод позволяет легко справиться с постоянной жёсткостью. Чтобы смягчить воду достаточно заморозить её до такого состояния, когда будет не более 10% воды, а 90% льда. Затем незамерзшая жидкость сливается, а вода в твёрдом состоянии растапливается и используется по назначению.
- Перегонка – все соли являются нелетучими веществами, поэтому достаточно воду сначала превратить в пар с помощью нагрева, а затем конденсировать.
- Электромагнитный способ – для смягчения жидкости используется электромагнитное поле. Данный способ уменьшения солей в воде применяется наиболее часто в котельных установках.
- Катионный обмен – высокоэффективный способ очистки воды от избыточного количество солей. Очищение происходит при пропускании воды через слой катионита.

Любой из предложенных способов умягчения воды позволяет справиться с высоким уровнем этого показателя, но для очистки от солей питьевой воды химический способ обычно не применяется.
Как влияет жёсткость на качество воды
Жёсткость питьевой воды влияет, прежде всего, на её вкусовые качества. Порог вкуса ионов кальция находящихся в питьевой воде составляет 2-6 мг-экв/л. Порог вкуса для ионов магния значительно ниже, поэтому самой приятной на вкус питьевой водой считается та, в которой этот показатель равен от 1,6 до 3 мг-экв/л.
В некоторых случаях вода с жёсткостью до 10 мг-экв/л может использоваться в качестве питьевой, но длительное её употребление может негативно влиять на здоровье человека. Слишком жёсткая вода нежелательна для применения в устройствах нагрева жидкости. Электрические чайники, бойлеры, стиральные и посудомоечные машины обязательно имеют в своей конструкции ТЭН, который в кратчайшие сроки “обрастает” отложениями, и процесс нагрева жидкости осуществляется менее эффективно.
Длительная эксплуатация электро нагревателя со значительным слоем накипи приводит к перегреву элемента и выходу его из строя. К счастью, для очистки от накипи достаточно растворить 2 пакетика лимонной кислоты в 1 литре воды и хорошо прокипятить чайник или любой другой водонагреватель. После чего следует тщательно промыть прибор и использовать его далее по назначению.
Смотреть видео
Негативно влияет высокое содержание солей воды и на процесс стирки. Растворение моющего вещества в воде богатой ионами калия и магния приводит к чрезмерному образованию пены. Пена способствует образованию налёта на элементах стиральной машины, который также может негативно влиять на работоспособность некоторых узлов этого бытового прибора.
Последствия для здоровья человека
При длительном употреблении жёсткой воды в организме человека наблюдаются серьёзные отклонения от нормы, которые прежде всего проявляются в работе следующих органов:
- Желудочно-кишечный тракт (ЖКТ) – при соединении солей входящих в состав жёсткой воды с животными жирами образуются соли жирных кислот, которые обволакивая стенки желудка и кишечника, препятствуя нормальной ферментации и значительно затормаживают перистальтику. В результате в организме накапливаются вредные вещества и шлаки, развивается дисбактериоз.
- Работа суставов – некоторые виды солей попадая в организм человека образуют неорганические вещества, которые со временем вытесняют синовиальную жидкость из суставов. В результате такого замещения происходит обрастание суставов кристаллами, которые вызывают сильную боль при движении. Длительное употребление жёсткой воды может привести к заболеванию артритом и полиартритом.
- Сердечно-сосудистая система – при значительном увеличении показателя жесткости питьевой воды, работа сердца ухудшается, вплоть до проявления выраженной аритмии.
- Состояние кожных покровов – жёсткая вода приводит к преждевременному старению кожи. Негативное воздействие наблюдается как при приёме жидкости внутрь, так и при мытье посуды. При контакте средства для мытья посуды с жёсткой водой образуется плёнка, которая при оседании на кожу долгое время оказывает негативное влияние на верхние слои эпидермиса.
- Образование камней в почках – данное утверждение является мифом, который развенчан благодаря работе учёных. Процесс камнеобразования не зависит от качества питьевой воды. Камни в почках образуются в основном из-за нехватки кальция в организме. В результате дефицита этого элемента происходит вымывание его из костей с оседанием в мочевыводящей системе.
Смотреть видео
Всех перечисленных недугов и болезненных состояний можно избежать, если использовать многоступенчатую фильтрацию воды. Применение таких устройств не будет стоить слишком дорого, а вот лечение различных патологий может обойтись в значительные суммы денег.
Методы определения жёсткости воды
Чтобы избежать негативного влияния на здоровье жёсткой воды, а также продлить срок эксплуатации нагревающим приборам, необходимо определить примерное количество солей калия и магния растворённых в жидкости. Сделать это на вкус довольно проблематично, ведь изменения могут быть выявлены таким способом только в случае превышения определённого значения.
Чтобы определить в домашних условиях большое содержание солей калия, магния и натрия можно воспользоваться следующими методами:
- Попытаться растворить мыло в воде, если пена не образуется, то вода очень жёсткая и употреблять её не следует.
- Если в чайнике и других приборах образуется большое количество накипи в течение небольшого промежутка времени, то вода, однозначно, превышает безопасные показатели этого значения.
- С помощью индикаторных полосок можно более точно определить количество солей в жидкости, но такой метод потребует небольших финансовых расходов. Для проведения опыта достаточно опустить индикаторную полоску в воду на несколько секунд, а через минуту сравнить её цвет с имеющейся в инструкции таблицей.
Смотреть видео
Заключение
Очень важно знать какой жёсткости вода используется для питья, а так же в котлах отопления и в других водонагревательных приборах. Необходимость применения точных единиц измерения для проведения вычислений в домашних условиях не всегда обязательно.
В химической промышленности и на других высокотехничных производствах, наоборот потребуется знать количество растворённых в воде солей до миллиграмма, поэтому можно использовать любые единицы измерения этого показателя, предложенные в данной статье, чтобы определить и, при необходимости, снизить количество солей в воде.
Смотреть видео
что это такое, как определить вид общей жесткости и в чем она измеряется, таблица определения норм в единицах измерения, какой вред человеку наносит и как устранить

Сегодня мы расскажем о понятии «жесткость воды», что это такое, ее виды, в каких единицах измерения ее определяют, есть ли допустимые нормы для питья, а также чем она плоха и какой вред для человека она может нанести. С данным термином мы сталкиваемся практически ежедневно при просмотре рекламы, а также при использовании порошка или моющего средства для посудомоечной машины, при установке фильтра. Но зачастую мы не подозреваем, какой показатель именно у нас – общий по городу или индивидуальный.
Вторая распространенная проблема, когда сталкиваются с данной характеристикой, – при монтаже собственной, индивидуальной точки доступа к скважине или колодцу. Обычно требуется произвести химический анализ, чтобы определить, какая фильтрационная система необходима. И при высоком содержании примесей (кальция и магния) требуется специальное оборудование для устранения данных солей. Но если вам не подскажет это специалист, необходимо самостоятельно разобраться в теме. Давайте это и сделаем.
Жесткость воды – что это такое

Это совокупное физико-химическое свойство жидкости, которое предопределяет ее использование и возможности эксплуатации в различных условиях, питьевое качество. Согласно второму определению, это уровень содержания в водном растворе примесей – солей щелочноземельных металлов (они в мельчайших фракциях находятся в подземных слоях), магния, кальция, а также других элементов, которые полностью не растворяются. Для этого следует понять, что Н2О – это только в учебниках химии, а в жизни химический состав гораздо более разнообразен.
Как понять, что вода жесткая, и что это значит? Легко определить повышенную жесткость можно в домашних условиях обычным кипячением. Если по краям после такого теста остался белый след, который красится как меловая крошка, то, скорее всего, это кальциевые отложения.

Данное свойство очень важно с точки зрения хозяйственного значения и потребительских качеств. Особенно это значимо с двух сторон:
-
для здоровья потребителей при употреблении в качестве напитка, а также при использовании в гигиенических процедурах, ведь волосы после мытья такой водой могут стать безжизненными и сухими, а кожа грубой;
-
для долговечности работы нагревательных элементов в стиральной и посудомоечной машинах (ТЭНы), чайниках и иных нагревателях – на них образуется накипь и они быстро выходят из строя.
Также это оказывает негативное воздействие на качество стирки, поскольку химические элементы препятствуют протеканию нормальной реакции стирального порошка, он может слабо вспениваться или недостаточно хорошо проникать в структуру ткани и избавлять ее от загрязнений.
Окружающая природа, горные породы и залежи различных полезных минералов совершенно разные на каждом участке гидродобычи (это зависит от почвы, близлежащих предприятий, глубины пролегания источника), поэтому в разных водоемах и жесткость различная. Именно по этой причине перед использованием обязательно берут пробы, делают химический анализ образца на наличие вредных веществ. Угадать наверняка без этого очень сложно, но можно указать на такую закономерность – чем глубже пролегают грунтовые воды, тем они более жесткие, на поверхности они мягче, поскольку протекают через меньшее количество различных земельных слоев.

Вторая тенденция характерна для природных, естественных водоемов и связана с таянием снегов и дождями. Максимальный показатель зимой, а минимальный – весной сразу после схода льда.
Дадим еще один простой вариант определения, каких примесей больше – магния или кальция. Магниевые соли хуже растворяются, поэтому дают осадок, также они имеют горький привкус.
А теперь посмотрим на сравнительную таблицу:
| Градусы dH |
| Жесткость в мг. х экв/л | Аналог в ppm | ||
| 13 – 22 | Жесткая | 8 – 12 | 210 – 320 | ||
| 9 – 12 | Средняя | 4 – 8 | 140 – 210 | ||
| 5 – 8 | Мягкая | 1,4 – 4 | 70 – 140 |
Шкала жесткости воды или как определить параметр по таблице
Сперва дадим график, согласно которому любую жидкость можно разделить на классы:

Alkaline – щелочная, она же карбонатная. Степень определяется наличием и концентрацией карбонатов и гидрокарбонатов кальция и магния. Особенность в том, что данные микроэлементы выпадают в осадок сразу после кипячения, поэтому такие водные растворы также называют непостоянными или временными.
Вторая часть шкалы Acidic – то есть, кислотосодержащая или некарбонатная. В ее составе не карбонаты и гидрокарбонаты, а кислотные соли на основе вышеперечисленных химических веществ. И они более устойчивые.
И есть также общая – она включает суммарное количество примесей. Чаще всего в бытовых ситуациях определяется именно последняя, то есть итоговая сумма микроэлементов. Но в ряде ситуаций имеет наибольшее значение именно одно состояние магниевых и кальциевых солей, их соединения. Если в анализе жидкости или в иной ситуации вы видите такую шкалу, то можно ориентироваться по цветам и картинке выше. То есть от 0 до 7 вы имеете дело с кислотными солями, а с 7 до 14 – с гидрокарбонатами.
Единицы измерения
Мы объяснили, какую воду называют жесткой, чем обусловлена общая жесткость и какие виды различают, теперь обсудим, в чем измеряется показатель и что на него влияет.
К сожалению, нет мирового стандарта, поэтому, используя аппаратуру европейского изготовления, будьте готовы к непонятным на первый взгляд обозначениям. Российскими учеными были установлены следующие единицы – моль на кубический метр. А перед этим ставится число, которое соответствует значению перевоплощения в миллиграммы на литр. А что можно встретить еще:
-
d° или dH – придумали в Германии, но применяют на всей территории Запада;
-
f° – пишут во Франции;
-
ppm CaCO3 – используют в США.
Жесткость: виды
По количеству примесей можно разделить воду на:
-
Мягкую. Она соответствует небольшой доли микроэлементов в составе. Получить ее можно после многочисленной обработки – специальной фильтрации, перегонки или многоразового кипячения, когда из-за термального воздействия карбонаты выпадают в осадок. Наибольшая мягкость у дождевой воды. Стоит отметить, что она благотворно воздействует на кожу, волосы, а также на здоровье в целом.
-
Среднюю. Это самый распространенный вариант, который считается приемлемым для бытовых и промышленных нужд. Именно поэтому такого качества жидкость идет по городскому и, вероятнее всего, по частному трубопроводу. Она вполне пригодна для приготовления пищи. В большинстве открытых природных водоемов вода тоже преимущественно средней жесткости.
-
Жесткую. В ней либо искусственным путем растворяют примеси, либо влага проходит через такие слои почвы, что сама быстро приобретает высокую концентрацию веществ. Самым распространенным вариантом можно считать морскую воду.
Как измерить и понять, допустимая или повышенная жесткость – способы

Представляем три варианта:
-
Наиболее точный – заказать лабораторный анализ. Во время пристального изучения будет произведен разбор на химические вещества, поэтому справка не только покажет общий показатель, но и конкретное содержание микроэлементов – какие и в каком объеме присутствуют в образце. Необходимо делать такую экспертизу владельцам частных домов при оборудовании скважины или колодца и заказе фильтрационной системы.
-
Быстрый и доступный каждому. Для этого стоит приобрести тестер в виде бумажной полоски. Его нужно опустить в жидкость, подождать указанный период, а затем определить цвет индикатора. Дело в том, что на активную части нанесен реагент, который вступает в реакцию и показывает количество примесей. Минус в сложности интерпретации и достаточно неточных результатах.

-
Домашний химический опыт. В два одинаковых мерных стакана следует нарезать по одному грамму хозяйственного мыла 72%. Затем залейте их подогретой водой – в одну емкость дистиллированной, во вторую водопроводной. В первом бокале будет уровень 7 см. А во втором – остановитесь вливать жидкость в тот момент, когда появится мыльная пена. Затем измерьте разницу влитой влаги. Каждый 1 см раствора соответствует двум °dH.
Какая должна быть оптимальная жесткость воды – норма
Как и единиц измерения, так и стандартов для всего мира общих нет. Зато в России в 2014 году появились жесткие нормативы, закрепленные ГОСТ 31865-2012. В нормативном документе показатель указывается в градусах и обозначается как °Ж. Он соответствует одному мг-экв/л. Посмотрим на таблицу нормативов, принятых у нас и в Америке:
| Качество жидкости |
| Пределы в США, в мг-экв/л | ||
| Мягкая (Soft) | <2 | <1,2 | ||
| Средняя (Moderate hardness) | От 2 до 10 | От 1,2 до 2,4 | ||
| Жесткая (Hard hardness) | >10 | От 2,4 до 3,6 | ||
| Очень жесткая (Very Hard hardness) | Нет нормы | >3,6 |
Как видим, российские требования гораздо более мягкие. Именно по этой причине бытовая техника, произведенная в Америке, служит гораздо меньше в контакте с нашим трубопроводом, чем у себя на родине.
Сравнивая европейские показатели, на примере Германии, мы сталкиваемся с такой же проблемой – у нас слишком гибкие рамки среднего качества. Таким образом, фактически любая водопроводная вода подходит под норматив.

Но употреблять такую жидкость попросту небезопасно, поэтому не стоит надеяться на государственные нормы, берегите здоровье своих домочадцев самостоятельно. Для этого устанавливайте системы фильтрации – обратитесь в компанию «Вода Отечества» для комплексной услуги установки фильтрационной системы на вашем участке.
Нормы для питьевой воды
Данный показатель регулирует не столько ГОСТ, сколько Всемирная Организация Здравоохранения и СанПиН. По рекомендации ВОЗ в одном литре жидкости для питья не может быть растворено более 30 мг магния и 80 мг кальция. А СанПиН 2.1.4.1074-01 предопределяет до 50 мг на магниевые отложение, кальциевые соли не регламентируются. Зато указана общая жесткость – до 7 градусов.
Влияние жесткой и мягкой воды – как отличить, рекомендации

ВОЗ утверждает, что употреблять необходимо только жидкость низкой или средней жесткости с установленными границами для примесей. Не всегда водопроводный ресурс, к сожалению, соответствует этим нормативам. Негативные последствия использования воды с повышенной жесткостью приводят к:
-
скорым поломкам бытовой техники – часто приходится заменять нагревательный элемент;
-
неисправностям инженерных систем – стенки труб постепенно разрушаются из-за образования отложений, а также засоряются;
-
испорченному здоровью;
-
мелким неприятностям – например, меняется вкус еды или качество постиранных вещей (моющий состав хуже пенится), мягкость вымытых волос.
Рекомендуем не дожидаться негативного воздействия и установить мощную систему фильтрации. Также стоит использовать не водопроводную, а специально подготовленную для питья жидкость, а при стирке или во время запуска посудомоечной машины добавлять специальные средства от накипи.
Вред для человека
Если соли поступают в чрезмерном количестве, они не успевают выводиться естественным образом и скапливаются в мочевых протоках и пузыре, почках – так начинается мочекаменная болезнь.
При умывании кожа становится более сухой, может образоваться раздражение. А на волосах появляется корочка, которая препятствует их естественному увлажнению и питанию подкожным жиром. Они становятся безжизненными.
Мясо, приготовленное в водном растворе с большим содержанием кальция, хуже усваивается организмом.
Как избавиться от жесткости воды и от чего она зависит

Если перед вами стоит вопрос что делать непосредственно с водопроводной жесткой водой, то выходов из ситуации не много:
-
поставить фильтр внутри квартиры, регулярно проверять систему и менять кассеты;
-
кипячение – стоит учесть, что данным способом можно убрать только карбонатный осадок, он останется внизу чайника или на его стенках, но если примесь в виде магниевых и кальциевых солей, способ не подходит;
-
заморозка – емкость следует проморозить так, чтобы на 90% образовался лед, а остальные 10% – слить, ведь именно концентрированный раствор замораживается медленнее всего.
Как повысить и понизить жесткость в аквариуме

Аквариумные рыбки – очень прихотливые создания, даже морские виды. У них всегда есть пределы, родной ареал обитания. Если вы хотите, чтобы они жили и размножались, следует воссоздать все необходимые условия.
Если нужно увеличить показатель солей, на дно можно положить известняк или мрамор, добавить хлористый кальций или магнезию.
В обратном случае придется прибегнуть к одному из вышеперечисленных трех способов. Чем больше объем резервуара, тем выгоднее будет создание фильтрационной системы.
Как избавиться от примесей в скважине
При бурении индивидуальной точки доступа к ресурсу просто необходимо делать предварительный анализ. Очень часто от этого зависит выбор расположения, а также глубина пролегания труб и насоса. Но если на участке испорченные грунтовые воды, поскольку они протекают через многочисленные солесодержащие почвенные слои, то и выбор места особенно не поможет, нужно производить фильтрацию. Обратитесь в компанию «Вода Отечества», чтобы специалисты выбрали для вас индивидуальное комплексное решение.
Методы устранения жесткости
Их несколько, все – эффективные. Выбирать следует, ориентируясь на конкретные показатели и степень эксплуатации – постоянно или сезонно.
Термоумягчение
Иными словами, это обычное кипячение. Следует немного приоткрыть крышку и ждать полного осадка примесей. Но если концентрация превышает 4 мл на литр, то способ не эффективен, поскольку испарение влаги произойдет быстрее, чем полное осаждение частиц.
Реагентное умягчение
В качестве реагентов чаще всего выступает обычная пищевая сода и известь. Они поочередно вводятся в раствор, отдельные химические элементы вступают с ними в реакцию с высвобождением Н2О и выпадают в осадок.
Катионирование
Это обессоливание с использованием катионов натрия или водорода. В первом случае это добавление обычной поваренной соли – что недорого, а также просто в утилизации продуктов регенерации.
Обратный осмос
В качестве фильтра выступает мембрана из ацетилцеллюлозы. С ее помощью достигается практически дистиллированная чистота. Такие установки небольшие, они хорошо берегут энергию. Но есть и минус – из раствора убираются практически все микроэлементы, а они важны для жизнедеятельности.
Электродиализ
Экологичный способ обессоливания. Он основывается на том, что вещества (положительные и отрицательные ионы) притягиваются к электродам под воздействием электрического заряда.
Дистилляция
Это промышленная перегонка жидкости. В ходе нагрева образуется водяной пар. Он впоследствии охлаждается и собирается как конденсат.
Вместо заключения
Мы рассказали, от чего зависит жесткость воды, чем она опасна и как ее устранить. Завершая тему, посмотрим видео:
Жесткость воды — это… Что такое Жесткость воды?
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой. Различают временную жёсткость, образованную гидрокарбонатами и постоянную жёсткость, вызванную присутствием других солей. Временная жёсткость может быть устранена кипячением.
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В тоже время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, хотя есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м3), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л).
В России для измерения жёсткости чаще используется нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Градус | Обозначение | Определение | Величина | |
|---|---|---|---|---|
| мг-экв/л | ммоль/л | |||
| Немецкий | °dH (dergees of hardness), °dGH (German (Deutsche) Hardness), °dKH (для карбонатной жёсткости) | 1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды | 0,357 | 0,179 |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | 0,285 | 0,142 |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | 0,200 | 0,100 |
| Американский | 3 на 1 000 000 частей воды | 0,02 | 0,01 | |
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими.
По величине общей жёсткости различают воду мягкую (до 2 мг-экв/л), средней жесткости (2-10 мг-экв/л) и жёсткую (более 10 мг-экв/л). Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка (например, жёсткость волжской воды в марте — 4,3 мг-экв/л, в мае — 0,5 мг-экв/л[1]). В подземных водах жёсткость обычно выше (до 80-100 мг-экв/л) и меньше изменяется в течение года.
Методы устранения
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготвки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Термический способ. Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в быту. В промышленности применяется, например, на ТЭЦ.
Реагентное умягчение. Метод основан на добавлении в воду соды или гашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. Как правило, жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л.
Ссылки
Примечания
- ↑ Химическая энциклопедия. — М.: Советская энциклопедия, 1990. Т. 2. С. 145.
Wikimedia Foundation.
2010.
Жесткость воды — MEL Chemistry
Реагенты
Безопасность
- Наденьте защитные перчатки и очки.
- Проведите эксперимент на лотке.
- Поставьте плиту на пробковую подставку для горячих горшков. Не трогайте плиту после эксперимента — дождитесь, пока она остынет.
- Перед зажиганием свечи снимите защитные перчатки.
Общие правила безопасности
- Не допускайте попадания химикатов в глаза или рот.
- Не подпускайте маленьких детей, животных и людей без защитных очков к экспериментальной зоне.
- Храните этот экспериментальный набор в недоступном для детей младше 12 лет.
- После использования очистите все оборудование.
- Убедитесь, что все емкости полностью закрыты и правильно хранятся после использования.
- Убедитесь, что все пустые контейнеры утилизированы надлежащим образом.
- Не используйте какое-либо оборудование, которое не входит в комплект поставки или не рекомендовано в инструкции по эксплуатации.
- Не заменяйте продукты в оригинальной упаковке.Немедленно утилизируйте.
Общая информация по оказанию первой помощи
- В случае попадания в глаза: промыть глаза большим количеством воды, при необходимости держать глаза открытыми. Немедленно обратитесь за медицинской помощью.
- При проглатывании: прополоскать рот водой, выпить свежей воды. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью.
- В случае вдыхания: вывести человека на свежий воздух.
- В случае контакта с кожей и ожогов: промыть пораженный участок большим количеством воды в течение не менее 10 минут.
- В случае сомнений незамедлительно обратитесь к врачу. Возьмите химическое вещество и контейнер с собой.
- В случае травмы всегда обращайтесь к врачу.
Консультации для взрослых
- Неправильное использование химикатов может привести к травмам и ущербу для здоровья.Выполняйте только те эксперименты, которые указаны в инструкции.
- Этот экспериментальный набор предназначен только для детей старше 12 лет.
- Поскольку способности детей сильно различаются даже в пределах возрастных групп, взрослые, наблюдающие за ними, должны проявлять осмотрительность при выборе подходящих и безопасных экспериментов для них. Инструкции должны позволять руководителям оценивать любой эксперимент, чтобы установить его пригодность для конкретного ребенка.
- Наблюдающий взрослый должен обсудить предупреждения и информацию о безопасности с ребенком или детьми до начала экспериментов. Особое внимание следует уделять безопасному обращению с кислотами, щелочами и легковоспламеняющимися жидкостями.
- В зоне, окружающей эксперимент, не должно быть никаких препятствий и места для хранения продуктов. Он должен быть хорошо освещен и вентилирован и находиться рядом с водопроводом.Должен быть предусмотрен прочный стол с термостойкой столешницей.
- Вещества в не подлежащей повторному закрытию упаковке должны быть израсходованы (полностью) в течение одного эксперимента, то есть после вскрытия упаковки.
Часто задаваемые вопросы и устранение неисправностей
Раствор в колбе не мутнеет после шага 6.
Вероятно, раствор в колбе еще недостаточно нагрелся.Подождите 5 мин. дольше.
Как пользоваться термостикером?
Наклейте наклейку на колбу или плиту. При температуре около 60–70 o С треугольник меняет цвет с черного на желтый, чтобы предупредить о том, что объект, к которому он был прикреплен, горячий и к нему нельзя прикасаться! Вы можете брать колбу или дотрагиваться до нее, только когда она остынет и треугольник снова станет черным.
Другие эксперименты
Пошаговая инструкция
- Налейте воду в колбу до отметки «40».
- Добавьте туда весь 0,2 М раствор хлорида кальция CaCl 2 из флакона.
- Возьмите топливную плиту и поставьте на нее свечу. Снимите защитные перчатки и зажгите свечу. Установите диффузор пламени на плиту, как показано.
- Установите колбу на диффузор пламени. Подождите 15 мин.
- Вылейте весь 0,3 М раствор гидрокарбоната натрия NaHCO 3 из флакона.
- Вода в колбе станет мутной.
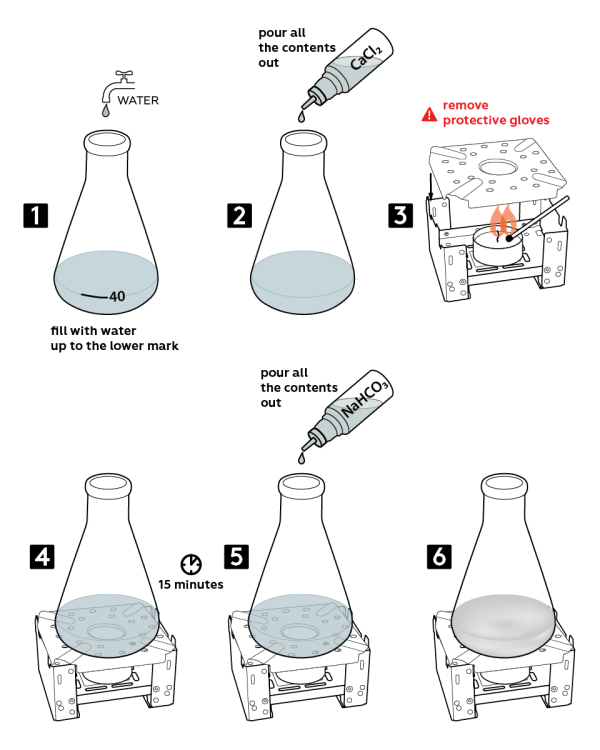
Утилизация
Утилизировать твердые отходы вместе с бытовым мусором.Вылейте растворы в раковину. Смыть большим количеством воды.
Научное описание
Что такое жесткость воды?
Жесткость воды — это величина, отражающая количество растворенных в воде солей кальция, магния и железа. Есть временная твердость (которую можно удалить) и постоянная твердость. Временная твердость обусловлена бикарбонатами кальция и магния (Ca (HCO 3 ) 2 и Mg (HCO 3 ) 2 ), а постоянная жгут — их сульфатами ((CaSO 4 и MgSO 4 ) и хлориды (CaCl 2 и MgCl 2 ).
Таким образом, жесткая вода — это вода, которая одновременно содержит много солей кальция, магния и железа.
Почему мы добавляем СаCl 2 ?
Добавляя в воду хлорид кальция CaCl 2 , мы искусственно увеличиваем ее жесткость. Как упоминалось выше, CaCl 2 вызывает постоянную (то есть не устраняемую кипячением) жесткость воды. И первая часть эксперимента продемонстрировала этот факт: при кипении на стенах не происходит заметных осадков.
Что происходит, когда мы добавляем NaHCO 3 ?
Добавление бикарбоната натрия NaHCO 3 дает образование бикарбоната кальция в растворе:
2NaHCO 3 + СаCl 2 ↔ Ca (HCO 3 ) 2 + 2NaCl
А из-за образования Ca (HCO 3 ) 2 жесткость нашей воды становится временной — теперь ее можно удалить кипячением.
Что происходит при нагреве воды?
При нагревании воды достаточно растворимый бикарбонат кальция превращается в плохо растворимый карбонат:
Ca (HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Белый налет на дне и стенках колбы — это карбонат кальция.
Почему образуется накипь и как ее удалить?
Накипь (или известковый налет) представляет собой нерастворимый карбонат кальция CaCO 3 , который выпал в осадок при термическом разложении бикарбоната кальция Ca (HCO 3 ) 2 :
Ca (HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Хотя толстый серый слой накипи не делает посуду красивее, он не приносит вреда. Кроме того, он может удалить излишнюю жесткость водопроводной воды.Кроме того, накипь легко удаляется с чайников и кастрюль, промывая их лимонной кислотой С 6 H 8 O 7 раствор:
3CaCO 3 + 2С 6 H 8 O 7 → Ca 3 (C 6 H 5 O 7 ) 2 + 3CO 2 + 3H 2 O
В результате реакции образуется цитрат кальция Ca 3 (C 6 H 5 O 7 ) 2 , который хорошо растворяется в воде.
Выучить больше
Грязно-бежевый цвет окалины обусловлен присутствием оксида железа Fe 2 O 3 . Водопроводная вода содержит некоторое количество железа в виде ионов Fe 2+ , но при кипячении оно выпадает в осадок.
Интересно, что по химическому составу накипь имеет тот же химический состав, что и природный известковый налет. Иногда они находят целые горы, образованные из этого минерала. Обычно в таких массивных природных образованиях есть многочисленные пещеры — излюбленные спелеологами! Эти пещеры легко образуются в известняке: даже слабокислая природная вода на своем пути растворяет карбонаты, образуя любопытные ходы в минерале.
Кроме того, карбонат кальция является основным компонентом обычного мела, который используется для письма на доске или рисования на асфальте. Кроме того, в качестве пищевой добавки используется мел — белый пищевой краситель Е170.
Напомним, что карбонат кальция — это вещество, придающее яичной скорлупе твердость. В наборе MEL Chemistry есть эксперимент «Химия пищи», в котором карбонат кальция растворяется обычным уксусом (см. Эксперимент «Резиновое яйцо»).
Как смягчить воду?
Вода с низким содержанием солей кальция и магния называется мягкой.А процесс снятия жесткости воды смягчается.
Самый простой способ смягчить воду, как показывает наш эксперимент, — это кипячение. При нагревании бикарбонаты кальция и магния (Ca (HCO 3 ) 2 и Mg (HCO 3 ) 2 ) подвергаются термическому разложению:
Ca (HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Mg (HCO 3 ) 2 → MgCO 3 + CO 2 ↑ + H 2 O
MgCO 3 + H 2 O → Mg (OH) 2 ↓ + CO 2 ↑
Кипячение (термическое умягчение) — древнейший способ умягчения воды для хозяйственных нужд.Конечно, этот процесс снимает лишь временную (карбонатную) жесткость. Постоянная жесткость сохраняется, как мы можем наблюдать в первой части нашего эксперимента: вода, насыщенная хлоридом кальция CaCl 2 , не оставляет осадка при кипячении.
Дистилляция тесно связана с кипячением. Следовательно, во время перегонки испарившаяся жидкость конденсируется на охлаждаемой поверхности и собирается в виде капель. Вода, очищенная таким способом, называется дистиллированной водой и не содержит ионов металлов.Дистиллированная вода из-за низкой минерализации не пригодна для питья, так как она «вымывает» минералы из организма. Однако дистиллированная вода широко используется в науке и промышленности.
Ниже вы можете найти более подробную информацию о современных методах смягчения воды.
Выучить больше
Очевидно, что кипячение — один из самых простых способов смягчить воду. Однако у такого процесса есть существенные недостатки, а именно низкая эффективность и высокое потребление энергии.
Другой способ смягчить воду — использовать реагенты. Они переводят ионы магния и кальция в нерастворимую форму, добавляя определенные химические вещества — например, гидроксид кальция Ca (OH) 2 (процесс называется размягчением извести):
Ca (OH) 2 + Ca (HCO 3 ) 2 → 2CaCO 3 ↓ + 2H 2 O
Mg (HCO 3 ) 2 + 2Ca (OH) 2 → Mg (OH) 2 ↓ + 2CaCO 3 + 2H 2 O
Смягчение извести, как и кипячение, устраняет только карбонатную жесткость.Для удаления постоянной (негарбонатной) жесткости необходимо более глубокое умягчение воды, поэтому в дополнение к гашеной извести используют карбонат натрия Na 2 CO 3 :
Ca 2+ + Na 2 CO 3 → CaCO 3 ↓ + 2Na +
Mg 2+ + Na 2 CO 3 → MgCO 3 ↓ + 2Na +
MgCO 3 + Ca (OH) 2 → Mg (OH) 2 ↓ + CaCO 3 ↓
Для еще более эффективного удаления ионов кальция и магния из воды используют «большие пушки» — фосфат натрия Na 3 PO 4 :
3Ca 2+ + 2Na 3 PO 4 → Ca 3 (PO 4 ) 2 ↓ + 6Na +
3Mg 2+ + 2Na 3 PO 4 → Mg 3 (PO 4 ) 2 ↓ + 6Na +
Недостатком этого метода умягчения воды является необходимость очень точного дозирования реагентов.
В промышленности наиболее широко применяемым методом умягчения воды является ионообменных смол . Вода проходит через специальный фильтр, задерживающий ионы кальция Ca 2+ , магния Mg 2+ , железа Fe 2+ и марганца Mn 2+ . Эти «пойманные» ионы заменяются ионами калия K + , натрия Na + или водорода H + , выделяемыми в раствор.
Этот метод очень эффективен для умягчения воды.Достоинства методики — невысокая стоимость реагентов и отсутствие сложных процедур, таких как осаждение и удаление осадка. Кстати, именно так умягчают воду в посудомоечной машине. Чтобы фильтр прослужил дольше, в посудомоечную машину наливают соль NaCl, чтобы она замещала кальций и магний и насыщала фильтр ионами натрия.
В лаборатории часто используют другой процесс очистки воды, называемый обратным осмосом. Кроме того, этот метод иногда используют даже в домашних условиях.Вода проходит через мембрану, не пропускающую соли металлов. Важно отметить, что обратный осмос может принимать только воду, которая уже была предварительно обработана. Мембрана очень тонкая и нежная: она может быть повреждена высокими концентрациями солей. Обратный осмос — очень дорогой процесс очистки воды, но, в свою очередь, он относительно быстрый и удобный.
Вот это интересно!
Какая вода лучше для вас: жесткая или мягкая?
Ответ прост: все хорошо в меру.Идеальным вариантом для повседневного домашнего использования является вода средней жесткости, содержащая некоторое количество солей кальция, магния, железа и марганца. Правильный баланс — всегда путь к гармонии.
Жесткая вода
Прежде всего, давайте разберемся, почему слишком жесткая вода — это проблема.
Регулярное употребление жесткой водопроводной воды может способствовать образованию камней в почках и мочевом пузыре. Нет никаких других доказанных с медицинской точки зрения потенциальных опасностей для здоровья человека от его употребления. Использование жесткой воды для купания или мытья лица может часто вызывать раздражение кожи, особенно у детей.Кроме того, жесткая вода может создавать неудобства в быту: соли кальция и магния, ответственные за жесткость воды, могут образовывать нерастворимые соединения с жирными кислотами, содержащимися в мыле. Мало того, что увеличивается расход мыла — в некоторых регионах из-за жесткости воды на умягчение воды уходит до 35% мыла, а то только 65% используется в гигиенических целях. К сожалению, это также приводит к осаждению нерастворимых солей (стеаратов) кальция и магния в канализационных трубах, таким образом оседая там мыльную пену.Сегодня большинство моющих средств, в отличие от обычного мыла, содержат синтетические добавки, не вступающие в реакцию с солями жесткости. Таким образом, сегодня уходит «мыльная проблема» жесткой воды. К сожалению, возникла другая проблема: в жесткой воде нагревательные элементы стиральных и посудомоечных машин постепенно откладывают слой накипи и в конечном итоге перестают работать из-за этого.
В домашнем хозяйстве жесткая вода доставляет некоторые неудобства, но в промышленных масштабах может создать настоящие неприятности. Даже слой известкового налета толщиной в миллиметр, осевший на внутренней части оборудования, резко снижает его эффективность теплообмена.Это не только увеличивает потребление электроэнергии для самого процесса, но также может повредить оборудование. Представьте себе огромный чайник, на дне которого постоянно образуется толстый слой известкового налета. Рано или поздно он выйдет из строя! А в промышленности они используют гораздо более сложные устройства и инструменты, чем чайник. Таким образом, как системы отопления, так и системы охлаждения требуют тщательного учета подаваемой воды.
Процессы с использованием химикатов также требуют тщательной очистки воды. Например, окрашивание текстиля возможно только с использованием особо мягкой воды, потому что некоторые красители могут образовывать нерастворимые соединения с ионами кальция, магния, марганца и железа.В жесткой воде этот процесс с некоторыми красителями может быть очень сложным.
Мягкая вода
Теперь давайте рассмотрим преимущества и недостатки использования мягкой воды.
Регулярное употребление мягкой воды может вызвать проблемы с зубами и костями, так как с питьевой водой мы обычно получаем значительное количество необходимых минералов. К счастью, проблема не такая уж и большая, поскольку потребность в кальции, магнии и марганце может быть удовлетворена за счет здорового питания.
В мягкой воде мыло пенится намного эффективнее, чем в жесткой воде. Однако для смывания моющего средства требуется значительно более мягкая вода, чем жесткая вода.
Кроме того, водопровод страдает от сверхмягкой воды: при нагревании вода с низкой концентрацией солей может постепенно растворять металлические конструкции.
В химической промышленности часто используют не просто умягченную воду, а дистиллированную. Дистиллированная вода не только очень мягкая, но и не содержит многочисленных примесей, совершенно не влияющих на жесткость воды, таких как сульфаты (SO 4 ) 2- , хлориды Cl — и натрий Na + . и ионы калия K + .
Дистиллированная вода: мягче не бывает
Дистиллированная вода — это вода, очищенная с помощью сложного процесса, называемого дистилляцией. Дистиллированная вода практически не содержит примесей.
Интересно, что дистиллированная вода может быть переохлаждена ниже точки замерзания или перегрета выше точки кипения!
Дистиллированная вода обычно используется в химических лабораториях и в химической промышленности, где чистота приготовленных растворов очень важна. Кроме того, дистиллированная вода используется в пищевой промышленности (для приготовления некоторых напитков), в автомобильной промышленности (для приготовления электролита для аккумуляторов), в медицине и цветной печати.
Существует также вода, дважды очищенная дистилляцией — это так называемая бидистиллированная вода. По составу она очень близка к химически чистой воде.
Есть ли способ получить воду еще более чистой? Для получения такой воды необходимо использовать гамма-излучение с последующим барботированием инертным газом — аргоном Ar.
Действительно, обычная вода содержит множество невидимых глазу примесей: соли, частицы пыли, минералы и органические соединения. Полная противоположность обычной воде — это химически чистая вода, которая содержит только молекул воды H 2 O.
,
Твердость
Накипные отложения — типичный индикатор жесткости воды.
Жесткая вода (или жесткость воды) — это обычное качество воды, которая содержит растворенные соединения кальция и магния, а иногда и другие двухвалентные и трехвалентные металлические элементы.
Термин «жесткость» первоначально применялся к воде, в которой трудно было мыться, имея в виду свойство жесткой воды расходовать мыло. Жесткость предотвращает пенообразование мыла, вызывая образование нерастворимого творожного осадка в воде; твердость обычно вызывает накопление шкалы твердости (например, на посуде).Растворенные соли кальция и магния в первую очередь вызывают образование накипи в трубах и водонагревателях и вызывают многочисленные проблемы в прачечной, на кухне и в ванной. Жесткость обычно выражается в зернах на галлон (или ppm) в эквиваленте карбоната кальция.
Что такое мягкая вода?
Мягкая вода определяется американскими национальными стандартами NSF / ANSI 44 и NSF / ANSI 330 как вода, имеющая жесткость <1 грана на галлон (или <17,1 мг / л).
Симптомы жесткой воды включают:
- Жесткое, грязное белье
- Минеральные отложения на посуде и стеклянной посуде
- Большое количество мыла и необходимость в кондиционерах для белья
- Дополнительная работа по удалению мыльного творога с ванн и душевых кабин
- Высокие затраты на электроэнергию, возможно, из-за накопления накипи в трубах и на приборах
- Накипь в раковинах, ваннах, смесителях и бытовой технике
Щелкните здесь , чтобы просмотреть национальные данные о наличии жесткой воды из США.С. Геологическая служба.
Обработка воды может улучшить проблемы с жесткостью.
Накипные отложения из-за накопления твердости влияют на приспособления и приборы, которые можно найти по всему дому или офису. По этой причине жесткость воды обычно решается при обработке воды для всего дома или здания, а не только для конкретного крана. Минералы жесткости можно снизить для всего дома, чтобы сделать его «мягче», используя одно из следующих средств:
- Химическое умягчение — умягчение извести, горячее и холодное; известково-содовый умягчитель
- Умягчение мембранного разделения — нанофильтрация
- Катионообменное смягчение — неорганические, углеродсодержащие или органические основные обменники
Щелкните здесь, чтобы найти поставщика услуг по очистке воды, который может помочь.
Щелкните здесь, чтобы найти продукты, сертифицированные WQA для снижения твердости (сертифицированы по стандарту NSF / ANSI 44).
,
Что такое жесткая вода? (с иллюстрациями)
Жесткая вода — это вода с высоким содержанием растворенных минералов, тогда как мягкая вода имеет относительно низкую концентрацию растворенных минералов. Вся вода, за исключением воды, которая была тщательно дистиллирована, будет содержать некоторые растворенные минералы, поскольку вода является отличным растворителем и легко соединяется с веществами, с которыми вступает в контакт. Однако высокие концентрации минералов могут быть проблематичными. Жесткая вода, как правило, не вредна, но может вызывать раздражение и сокращать срок службы бытовой техники, такой как посудомоечные и стиральные машины.

Люди часто не чувствуют себя чистыми, принимая душ с жесткой водой.
Наиболее распространенными минералами, растворенными в бытовой воде, являются кальций и магний, хотя, безусловно, могут присутствовать и другие минералы. Эти вещества могут вызвать серьезные проблемы для бытовой техники, когда они выпадают в осадок, образуя характерный налет, который может накапливаться в трубах и вокруг кранов.Если накипь не удалить сразу, она может начать забивать трубы и повредить такие вещи, как водонагреватели и посудомоечные машины, которые не справляются с минералами.

Многие предпочитают вкус жесткой питьевой воды.
Большинство людей замечают проблемы с жесткой водой не из-за образования накипи, а из-за того, что она мешает действию мыла. Мыло и моющие средства плохо вспениваются в воде, содержащей минералы, и в результате люди склонны использовать их больше, вызывая образование густой пены. Кроме того, при стирке жесткой водой трудно правильно очиститься, и некоторые люди постоянно чувствуют себя немного грязными, когда мыть в ней.Он также оставляет на волосах остатки, из-за которых сложно укладывать волосы.

Жесткая вода может вызвать проблемы в посудомоечных машинах.
Есть несколько способов справиться с жесткой водой.В некоторых случаях воду можно отфильтровать еще до того, как она попадет в домашние трубы, хотя такой подход может быть дорогостоящим. Некоторые водные районы могут фильтровать или обрабатывать воду для удаления минералов, если жесткость является постоянной проблемой. Проблему также можно решить с помощью смягчителей воды, химикатов, которые помогают вывести растворенные минералы.

Жесткая вода — это водопроводная вода с высоким содержанием минералов.
Людям с жесткой водой следует использовать специально разработанные для нее моющие средства. Стиральные порошки помогут очистить одежду, если она не такая хрустящая и свежая, как должна быть, и некоторые косметические компании также разработали средства для душа, которые предназначены для использования в такой воде. Эти мыла и шампуни удаляют минеральные отложения и смягчают воду, в которой человек принимает ванну, чтобы он или она чувствовали себя чистыми.

Людям, у которых жесткая вода, следует использовать специально разработанные для нее моющие средства.
Домовладельцам с жесткой водой также важно следить за своими трубами и приборами и регулярно удалять известковые отложения. Домовладельцам, вероятно, придется заменять водонагреватели чаще, чем людям, использующим мягкую воду, и они могут захотеть рассмотреть возможность установки водяного фильтра на впускном клапане водонагревателя, чтобы смягчить воду и продлить ее срок службы. Также доступны фильтры для посудомоечных и стиральных машин.

Жесткая вода может разъесть трубы и привести к утечкам.
Некоторые шампуни и мыла специально разработаны для использования в жесткой воде.
,
Встряхивание пудры: какой тип воды самый тяжелый?
| Области науки | Химия |
| Сложность | |
| Требуемое время | Короткий (2-5 дней) |
| Предварительные требования | Нет |
| Наличие материалов | Легко доступны |
| Стоимость | Очень низкий (менее 20 долларов США) |
| Безопасность | Обязательно используйте защитные очки, если вы используете стеклянные сосуды для тестирования. |
Абстрактные
Хотите, чтобы после мытья волосы сияли? Хотите, чтобы ваша одежда оставалась яркой и мягкой после стирки и долго прослужила? Вы можете подумать, что это может произойти с помощью специального шампуня или моющего средства, но в этом проекте химической научной ярмарки вы обнаружите, что то, насколько хорошо люди и вещи чистятся, гораздо больше связано с водой типа , используемой для стирки. чем любой специальный шампунь или мыло.Знаете ли вы, что воду можно разделить на мягкую или жесткую? Мягкая вода пенится и очищает лучше, чем жесткая вода. Используя эту подсказку, вы протестируете различные распространенные типы воды, чтобы выяснить, какой из них самый мягкий, а какой самый твердый.
Объектив
Для определения относительной жесткости различных распространенных типов воды.
Поделитесь своей историей с друзьями по науке!
Да,
Я сделал этот проект!
Пожалуйста, войдите в систему (или создайте бесплатную учетную запись), чтобы сообщить нам, как все прошло.
Планируете ли вы сделать проект от Science Buddies?
Вернитесь и расскажите нам о своем проекте, используя ссылку «Я сделал этот проект» для выбранного вами проекта.
Вы найдете ссылку «Я сделал этот проект» на каждом проекте на сайте Science Buddies, так что не забудьте поделиться своей историей!
Кредиты
Кристин Стронг, Друзья науки
Цитируйте эту страницу
Здесь представлена общая информация о цитировании.Обязательно проверьте форматирование, включая использование заглавных букв, для метода, который вы используете, и обновите цитату по мере необходимости.
MLA Стиль
Сотрудники Science Buddies.
«Встряхивание пудры: какой тип воды самый тяжелый?» Друзья науки ,
23 июня 2020,
https://www.sciencebuddies.org/science-fair-projects/project-ideas/Chem_p094/chemistry/water-harness.
Проверено 8 августа 2020 г.
APA Style
Сотрудники Science Buddies.(2020, 23 июня).
Встряхивание пудры: какой тип воды самый тяжелый?
Полученное из
https://www.sciencebuddies.org/science-fair-projects/project-ideas/Chem_p094/chemistry/water-harness
Дата последнего редактирования: 2020-06-23
Введение
Вы любите принимать ванну с пеной, наполненную густой шипящей пеной, в которую можно погрузиться? Вам нравится брать эти пузыри и покрывать себя с головы до пят белой пеной, пока не станете похожи на старика-зиму? Или вы лепите из пузырей башни и горы или прячете в них свои игрушки для ванны, чтобы злая акула не могла их съесть?
Рисунок 1. На этом фото изображены резиновые уточки, принимающие ванну с кипящей водой. (Викимедиа, 2006.)
Как бы вам ни нравились пузыри в ванне, вы можете быть удивлены, узнав, что когда вы наливаете небольшое количество жидкого мыла в воду, выходящую из крана, количество пузырей, которые вы можете сделать, зависит от жесткости вашей воды , Вы можете подумать: «Что? Вода не жесткая! Вы можете легко положить в нее руку, верно?» Это правда, но термин жесткость , , когда он используется для обозначения воды, имеет другое значение.Жесткость — это слово, которое геологов, и другие ученые-водники, такие как гидрологов, используют для описания того, сколько крошечных частиц из минералов находится в воде.
Минералы — это строительные блоки горных пород. Минералы производятся не людьми, а природой. Если вы когда-нибудь видели алмаз, изумруд или рубин, вы видели особый и дорогой минерал, называемый драгоценным камнем . В воде общие минералы, которые вы найдете, — это , кальций, и , катионы магния, (произносится как CAT-eye-un).Катионы — это атомы, у которых отсутствуют некоторые из своих электронов и (отрицательно заряженные части атома).
Рисунок 2. На этой фотографии показаны образцы красивых минералов. (Мила Зинькова, 2007).
Как эти минералы попадают в воду? Чтобы понять это, вам сначала нужно немного узнать о кислотах , и основаниях. Чистая вода нейтральная, означает, что она не является кислой или щелочной; однако дождевая вода на слегка кислая, как апельсиновый сок.Когда эта слегка кислая дождевая вода проходит через минеральные отложения, такие как кальцийсодержащий известняк , который использовался для строительства Великих пирамид Египта, она вступает в реакцию с минералами и преобразует их в форму, которая может быть растворена в воде, просто так как вы можете растворить ложку сахара в стакане воды. Таким образом, в водопровод попадают катионы кальция и магния.
Жесткость воды везде одинакова? Нет, взгляните на приведенную ниже карту Соединенных Штатов, предоставленную Геологической службой США.Области темно-синего цвета — это те места, где вода самая «мягкая», с низким уровнем растворенных минералов в воде. Области, отмеченные средним синим и белым цветом, имеют более высокие уровни растворенных минералов, а уровни красного цвета — это области, где вода наиболее жесткая, с высоким уровнем катионов кальция и магния в воде. Итак, если вы живете в таких штатах, как Мэн, Вермонт, Каролина, Алабама или Джорджия, возможно, вы никогда даже не слышали о жесткой воде, но если вы живете в таких штатах, как Юта, Вайоминг, Колорадо, Небраска или западный Техас, жесткая вода вода — это то, с чем вы имеете дело каждый день.
Карта, показывающая жесткость воды с 344 станций сбора воды в Соединенных Штатах в 2005 году. Уровень жесткости грунтовых вод повышен до более 151 мг / л в среднем западном регионе континентальной части Соединенных Штатов, простираясь от самых северных районов Северной Дакоты до самая южная оконечность Техаса и простирается на запад до южной оконечности Калифорнии. Жесткость воды на западном и восточном побережье ниже 120 и 50 мг / л, причем в большинстве штатов мягкая вода простирается от северного Мэна до южной Луизианы и на восток через северную Флориду.
Рис. 3. На этой карте США цветом показаны наиболее жесткие и мягкие уровни воды. Красные области содержат наиболее растворенные катионы кальция в воде и самую жесткую воду, а темно-синие области имеют наименьшее количество растворенных катионов кальция в воде и, следовательно, самую мягкую воду. (Геологическая служба США, 2005 г.)
Что происходит, если у вас жесткая вода? Что ж, чем жестче вода (чем больше у вас минералов жесткости кальция и магния), тем больше мыла или моющего средства вам нужно для очистки.Другими словами, чем жестче вода, тем меньше мыльная пена. Итак, если вы живете в районе с жесткой водой и хотите вымыть одежду, посуду или себя, вымыть эти вещи будет труднее, чем если вы живете в районе с мягкой водой — вода без много растворенных минералов. Жесткая вода препятствует или снижает пенообразование (образование пены или пузырьков). Из-за жесткой воды пленка может накапливаться на дверях и стенах душевых, а также на ваннах, раковинах и смесителях. Волосы, вымытые в жесткой воде, могут выглядеть менее блестящими, чем волосы, вымытые в мягкой воде.Ткани для одежды могут быть тусклыми, серыми, царапающимися и изнашиваться быстрее. Наконец, водопроводные трубы в вашем доме и приборы, использующие воду, могут со временем перестать работать из-за накопления отложений жесткой воды. Плохо ли иметь жесткую воду? Нет. На самом деле считается, что минералы в жесткой воде способствуют здоровью человека. Жесткая вода в основном беспокоит, когда дело доходит до чистки или поддержания исправности труб и водозаборных устройств.
Итак, как измерить жесткость воды? Существуют химические наборы, которые приблизительно сообщают вам, сколько крошечных частей кальция и магния содержится в вашей воде, но в этом проекте химической научной ярмарки вы собираетесь использовать жидкое мыло для сравнения жесткости различных видов воды.Вы увидите, насколько высоко можно создать пузырящуюся пену с каждым типом воды.
Термины и понятия
- Твердость
- Геолог
- Гидролог
- Частица
- Минерал
- Кальций
- Магний
- Катион
- Электрон
- Кислота
- База
- Известняк
- Растворять
Вопросы
- В чем разница между жесткой и мягкой водой?
- Жесткость воды везде одинакова?
- Какие проблемы вызывает жесткая вода?
Библиография
Информацию о жесткой воде см. В следующих источниках:
Этот источник описывает, что такое минералы:
- Музей естественной истории Оксфордского университета.(Н.о.). Что такое минерал? Зона обучения. Проверено 20 августа, 2014.
Чтобы получить помощь в создании графиков, посетите этот веб-сайт:
- Национальный центр статистики образования (без даты). Создайте график. Проверено 8 января 2010 года.
Лента новостей по этой теме

Примечание: Компьютерный алгоритм сопоставления предлагает указанные выше статьи. Это не так умно, как вы, и иногда может давать юмористические, смешные или даже раздражающие результаты! Узнать больше о ленте новостей
,
