Химические свойства серебра — Знаешь как
Содержание статьи
 По своей химической активности серебро занимает промежуточное положение между золотом и медью. С кислородом серебро непосредственно не соединяется, но в расплавленном состоянии растворяет около 20 объемов кислорода на один объем металла.
По своей химической активности серебро занимает промежуточное положение между золотом и медью. С кислородом серебро непосредственно не соединяется, но в расплавленном состоянии растворяет около 20 объемов кислорода на один объем металла.
В твердом серебре растворимость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопровождающееся иногда разбрызгиванием металла.
С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов.
При нагревании с серой серебро легко образует сульфид Ag2S. Это же соединение получается при действии на серебро газообразной серы, выделяющейся при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами. При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных условиях и является причиной постепенного потемнения серебянных изделий.
Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают, даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света.
Электродный потенциал серебра в водных растворах высок :
Ag → Ag⁺ + е, φ0 = + 0,799В
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной. Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl.
Такие различия в поведении золота и серебра часто используют для разделения этих металлов. Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомочевины в присутствии солей железа (III).
Соединения серебра
В подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют.
Оксид серебра Ag2О
Черно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag⁺. Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид:
Ag⁺ + OH⁻ = AgOH;
2AgOH = Ag2O + Н2О.
Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гидролизуются и дают нейтральную реакцию. При нагревании до 185—190°С Ag2О разлагается на элементы. Перекись водорода легко восстанавливается Ag2О уже при комнатной температуре:
Ag2О + Н2О2 = 2Ag + Н2О + О2.
В водном растворе аммиака Ag2О растворяется с образованием комплексного соединения:
Ag2О + 4NH4ОH = 2Ag(NH3)2OH + 3H2О.
При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро).
Галогениды серебра
Малорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и иодид AgI выпадают в осадок при введении в раствор, содержащий ионы Ag⁺ (например, раствор AgNO3), ионов Сl⁻, Вr⁻ и I⁻. Их произведения растворимости составляют соответственно 1,8 • 10⁻¹º (AgCI), 5,3 • 10⁻¹³ (AgBr) и 8,3 •10⁻¹⁷ (AgI).
В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НСl. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000 °с.
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN⁻, S2O²3⁻, SO²3⁻ Cl⁻, Nh4, CS(Nh3)2 и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например:
AgCl + 2CN⁻ = Ag (CN)F + Сl⁻;
AgCl + 2S2C²3⁻ = Ag (S2O2)³2⁻ + Сl⁻;
AgCl + 2Nh5OH = Ag(Nh4)2+ + Сl⁻ + 2h3O.
Вследствие образования комплексов с ионами Сl³⁻ хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов:
AgCl + Сl⁻ = AgCl⁻ 2.
Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7•10³⁻моль/л (0,72 г/л Ag) против 1,3•10⁻⁵ в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига.
Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в ре-зультате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора.
Электроотрицательными металлами (цинком, железом) .хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве.
Бромид серебра AgBr похож по своим свойствам на AgCl. Он растворим в аммиачных, тиосульфатных, сульфитных и цианистых растворах, легко восстанавливается до металла.
Иодид AgI
Наименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN⁻ и S2O²3⁻ , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью AgI обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов AgI⁻2.
Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувст-вительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид:
2AgГ=2Ag+Г2
Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов — светочувствительных пленок, пластинок и бумаги. Светочувствительность галидов серебра возрастает в ряду AgI<AgCl<AgBr, поэтому чаще всего для производства фотоматериалов используют бромид серебра.
К галогенидам серебра очень близок по своим свойствам цианид AgCN. Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag⁺, раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3•10⁻¹⁶) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается.
Нитрат серебра
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgNО3 получают действием азотной кислоты на металлическое серебро:
3Ag + 4HNO3 = 3AgNО3 + NO + 2h3О.
Нитрат серебpa представляет собой бесцветные негигроскопичные кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается. AgNО3 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100 °С она возрастает до 952 г на 100 г.
В присутствии органических веществ нитрат серебра чернеет вследствие частичного восстановления до металла.
Нитрат серебра — технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNO3 используют в качестве электролита при электролитическом рафинировании серебра.
Сульфат серебра Ag2SO4
Может быть получен растворением металлического серебра в горячей концентрированной серной кислоте:
2Ag + 2h3SO4 = Ag2SO4 + SO2 + 2Н2O.
Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660°С. При температуре выше 1000°С термически разлагается. Растворимость Ag2SO4 в воде невелика, при 25°С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHSO4.
Сульфид серебра Ag2S — наиболее трудно растворимая соль этого металла (произведение растворимости 6.3• 10⁻⁵º). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии h3S на металлическое серебро в присутствии влаги и кислорода воздуха;
4Ag + 2h3S + O2 = 2Ag2S + 2Н2O
Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой.
В цианистых растворах Ag2S растворяется в результате образования комплексного соединения:
Ag2S + 4CN⁻ ⇄ 2Ag(CN)⁻2 + S²⁻
Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN⁻ и удаление ионов S²⁻ окислением их кислородом продуваемого воздуха.
С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы:
Ag2S + О2 = 2Ag + SО2
Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха:
4Ag + 8CN⁻ + О2 + 2Н2О = 4Ag(CN)7 + 4ОН⁻
Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования.
Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III),образуя комплексные катионы Ag[CS(NH2)2]⁺2
Статья на тему химические свойства серебра
Серебро Серебряная вода — Справочник химика 21
В тщательно вымытую пробирку наливают аммиачный раствор оксида серебра и добавляют несколько капель ацетальдегида. Пробирку помещают в баню с горячей водой. Через некоторое время на стенках образуется слой серебра ( серебряное зеркало ). Эта реакция является качественной на альдегиды. Попробуйте провести подобную реакцию с ацетоном. Объясните, почему ацетон не восстанавливает серебро. [c.56]
Растворимость одного вещества в другом — свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда имеет место переход веществ через поверхность их контакта. Любой металл растворяется в воде, однако растворимость в ряду металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и в растворе образуются гидроксиды металлов. Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается так называемая серебряная вода . Таким образом, одни металлы активно растворяются в воде, другие — крайне мало. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает отрасль химической науки — электрохимия. [c.257]
Заслуживает быть отмеченным, что ион Ag при содержании в воде даже в чрезвычайно малой концентрации (порядка 10 г л) проявляет заметное бактерицидное действие (убивает бактерии). Препараты серебра получили название серебряной воды и находят практическое применение в медицине, для консервирования пищевых продуктов. [c.408]
Вода, выдержанная в серебряном сосуде ( серебряная вода ), обладает бактерицидными свойствами. Пред.южи-те уравнения возможных реакций перехода серебра в воду в виде ионов Ag+. [c.121]
Еще в глубокой древности было известно, что вода, находящаяся в контакте с металлическим серебром, приобретает целебные свойства. Древние индусы обеззараживали воду погружением в нее пластинок из металлического серебра. В русской православной церкви прихожане получают святую воду, которая выдерживается в серебряных сосудах. В некоторых странах существовал обычай при освящении колодцев бросать в них серебряные монеты. Поскольку эти наблюдения были сделаны разными народами и в различных частях света, должна быть объективная причина проявления особых свойств серебряной воды. В настоящее время существует широко распространенное мнение, что активным началом этой воды являются не атомы серебра, а ионы Есть экспериментальные данные, свидетельствующие о том, что эти ионы способны проникать внутрь клеток бактерий и нарушать их жизнедеятельность. Эффективность уничтожения бактерий в воде, содержащей следы ионов серебра, чрезвычайно высокая — в 1750 раз выше, чем действие карболовой кислоты. Бактерицидность серебряной воды сохраняется в течение многих месяцев. [c.16]
Ртуть представляет собой жидкий металл, напоминающий по блеску серебро, поэтому греки называли ее серебряная вода . [c.124]
Исследованиями доказано, что ионы серебра убивают грам-положительные и грамотрицательные микроорганизмы, а также вирусы. В нашей стране академиком АН СССР проф. А. А. Куль-ским был разработан электролитический метод приготовления серебряной воды (обогащение воды серебром при помощи электролиза). [c.136]
Серебряная вода. О ее свойствах можно прочитать в ряде книг и публикаций (см., например, [7]). В нашем списке искусственных вод она вызывает наибольшее доверие, так как бактерицидные свойства серебра известны с глубокой древности. Еше в Древней Индии с помощью этого металла обеззараживали воду, а персидский царь Кир хранил воду в серебряных сосудах.) Бактерицидные свойства серебра подтверждены и современной наукой. [c.53]
Серебро — важный для нас микроэлемент необходимый для нормального функционирования желез внутренней секреции, мозга и печени. Но повторю еще раз этот факт — не основание, чтобы увлекаться питьем серебряной воды с большой концентрацией ионов. [c.55]
Серебро применяется для выделки разменной монеты, для изготовления частей аппаратуры некоторых химических производств, для украшений. Из него делают серебряные тигли, которые применяются в химических лабораториях для плавления щелочей. Мелкораздробленное серебро применяется в санитарной технике и медицине для обеззараживания воды. При контакте с водой ничтожная доля серебра переходит в раствор в виде ионов серебра, которые обладают бактерицидными свойствами. Такая серебряная вода может служить также для консервирования продуктов. [c.10]
СЕРЕБРО И МЕДИЦИНА. О бактерицидных свойствах серебра, о целительности серебряной воды писали много. В особо крупных масштабах воду серебрят на океанских кораблях. В специальной установке, ионаторе, пропускают переменный ток через воду. Электродами служат серебряные пластинки. За час в раствор переходит до 10 г серебра. Этого количества достаточно, чтобы дезинфицировать 50 кубометров питьевой воды. Насыщение воды ионами серебра строго дозируют избыток ионов представляет определенную опасность — в больших дозах серебро токсично. [c.21]
Работы по бактерицидному действию малых концентраций солей серебра подтвердили необходимость продолжительного времени контакта воды с посеребренным песком при использовании последнего для дезинфекции [127]. Существенным недостатком этого метода является не только длительность процесса обогащения воды серебром, но и невозможность управлять им из-за того, что скорость растворения металла зависит от состояния его поверхности, солевого состава, органических примесей природной воды и т. д. При получении серебряной воды таким методом не удается дозировать серебро и осуществлять контроль над процессом. [c.329]
Нами детально изучены условия получения и свойства серебряной воды [127—140]. Предложенный электролитический метод, основанный на анодном растворении серебра, обеспечивает быстрое получение желаемых концентраций металла, позволяет вести точную дозировку и регулирование процесса при помощи электроизмерительных приборов.. [c.329]
Серебряная вода, приготовляемая электролитическим растворением металлического серебра, обладает высокими бактерицидными свойствами [c.329]
С тех пор было предложено несколько теорий, объясняющих эффект воздействия серебра иа бактерии. Из них наиболее признанной является ионная теория. Согласно ей действующим началом серебряной воды являются не атомы серебра, а его ионы, вероятнее всего — гидратированные. [c.208]
И здесь мы наблюдаем сходную картину, как и при рассмотрении воды магнитной, скользкой или активированной воздействие постороннего фактора — в данном случае совсем незначительных количеств серебра — не оставляет видимых следов на воде (цвет, вкус, запах, агрегатное состояние ее остаются неизменными), и тем не менее вода приобретает свойства, которые делают ее целебной и целящей, словом, серебряной водой. И несмотря на то, что еще многое в сущности самого явления образования серебряной воды остается невыясненным, как и механизм ее участия во многих биологических процессах, это не препятствует ее широкому практическо
Вода и серебро: факты и предостережения

В серебряном сосуде вода не портится, купели в церкви сделаны из серебра, персидский царь Кир возил воду на войне в серебряных чанах— таков набор общеизвестных в наше время аргументов в пользу «серебряной воды». Но автору известен случай, когда вполне современный молодой батюшка прибежал к врачам советоваться — предстояло крестить собственное чадо… Усомнился!
Не мнительный ли перестраховщик батюшка?
Ответ на этот вопрос интересно поискать в научной литературе.
В конце прошлого века швейцарский ботаник Карл Негели впервые описал действие слабых растворов серебра на клетки пресноводных водорослей. Он назвал это явление олигодинамией. («Олигос» — следы, «динамис» — действие. Действие «следов», крайне малых количеств).
Четкой теории процесса построить не удалось, и долгое время серебру приписывали даже некую «неведомую силу». В начале нашего столетия в Западной Европе (Австрия, Германия) появились публикации, авторы которых утверждали, что бактерицидное (губительное для бактерий) действие серебра сказывалось даже через воздушную прослойку между ним и зараженной поверхностью. Работа советского исследователя В Д. Славина в 1936 году опровергла это чудо: дело было в неверной трактовке контрольных опытов.
В работах, посвященных действию растворов серебра( удивителен полнейший разнобой. Одни установили, что для бактерий губительны только ничтожные количества серебра в зараженной воде. Другие убедительными опытами показали, что количества эти должны быть вовсе не такими ничтожными. Это миллиграммы или десятые доли миллиграмма в литре. Одни наблюдают эффект через 10 минут. Другие видят, что бактерии гибнут только через несколько часов… Кто же прав? Правы, очевидно, все. Так в науке не бывает? Увы, бывает, когда условия опытов неодинаковы. В последние годы стало ясно, что одна и та же доза серебра ведет себя в отношении Бактерий по-разному в различной по химическому составу воде. Если в воде больше хлоридов, то серебро действует хуже. Чем больше бактерий (например, в сильно загрязненной колодезной воде), тем слабее действие серебра. Оказывается, не все равно, какое серебро ввести в воду. Ведь можно электролитическим путем ввести в воду ионы чистого серебра, можно растворить азотнокислое серебро, можно, наконец, использовать коллоидные соединения. И сравнение убедительно показывает, что разные препараты действуют неодинаково…
Многие ошибки прошлых исследований объясняются и тем, что стенки сосудов в которых ученые изучали растворы, понемногу «серебрились», сорбировали на себе серебро. И его концентрация в следующем опыте увеличивалась без ведома экспериментаторов, потому что они… не меняли лабораторную посуду после каждого опыта. И вообще, как это ни покажется странным, точная методика аналитического определения серебра в воде появилась только в последние годы. Ее применение позволяет теперь судить о предмете исследования гораздо четче.
Изменилась со временем и бактериологическая оценка опытов. Раньше исследователь «пускал» в 1 литр воды 100 000 бактерий (например, кишечной палочки), действовал той или другой концентрацией серебра и получал, например, такой результат гибели бактерий: 99%. Казалось бы, прекрасный эффект. Однако сейчас в СССР государственный стандарт на качество питьевой воды допускает, чтобы в 1 литре находилось не более трех кишечных палочек. И результат прежнего опыта выглядит неутешительно, потому что 1 % оставшихся в живых бактерий — это 1000 штук в литре, в 333 раза больше нормы…
Но вернемся к нашему батюшке-перестраховщику. Что же происходит со «святой водой», что происходит в купелях? Происходят вполне объяснимые вещи. Действительно, если в литр чистой воды ввести сотые доли миллиграмма серебра, то (при условии ее хранения в закупоренном сосуде) микробы в ней не развиваются. Но «не дай бог» они туда попадут — и «святые свойства» воды исчезнут: убить микробов в уже зараженной ими воде можно только большими дозами серебра. Кстати, когда врачи поинтересовались бактериологическим загрязнением «святой» воды в церковной утвари, результаты оказались плачевными — рост бактерий наблюдался во многих пробах.
С другой стороны, можно предполагать, что церковники иногда фабрикуют «святую воду» именно с помощью увеличенных доз серебра (растворяя азотно-кислое серебро или даже прибегая к электролитической диссоциации).
Тут возникает вопрос — безвредны ли повышенные концентрации серебра?

Специальные исследования в этой области пока немногочисленны. Не и сейчас санитарные законы в некоторых странах ограничили допустимые количества серебра в воде весьма малыми величинами. Например, в США введена предельно допустимая концентрация серебра в литьевой воде 0,05 мг/л. Это гораздо меньшее содержание серебра, чем потребовалось бы для обеззараживания воды! У нас применение растворов серебра внутрь для лечебных целей даже запрещено Министерством здравоохранения Украинской ССР.
Разумеется, серебряная посуда и столовое серебро полностью безвредны (и, кроме того, красивы!), так что в этом отношении никаких опасений возникать не должно. Но ведь дело совсем не только в посуде! Сейчас кое-кто увлекся «самодеятельным» получением серебряной воды электро-литическим путем. Распространилось мнение о ее целебных свойствах…
Хочу еще раз предупредить каждого читателя: введение в организм значительных количеств серебра не безвредно! Только врач, выбирая метод лечения, может сопоставить вероятный его эффект с возможным побочным действием препарата. Врач и только врач!
Если в воде содержится серебро в дозе, убивающей бактерии, то употребление такой воды для питья может причинить вред здоровью.
Так что волновался батюшка в общем-то не зря…
Э. О. ЛЕОНИДОВ
Серебро | Химические свойства
Серебро
Серебро проявляет химические свойства, характерные для элементов Iб подгруппы периодической системы Менделеева. В соединениях обычно одновалентно. Серебро находится в конце электрохимического ряда напряжений, его нормальный электродный потенциал Ag = Ag+ + e— равен 0,7978 в.
При обычной температуре Ag не взаимодействует с О2, N2 и Н2. При действии свободных галогенов и серы на поверхности Серебра образуется защитная пленка малорастворимых галогенидов и сульфида Ag2S (кристаллы серо-черного цвета). Под влиянием сероводорода H2S, находящегося в атмосфере, на поверхности серебряных изделий образуется Ag2S в виде тонкой пленки, чем объясняется потемнение этих изделий. Сульфид можно получить действием сероводорода на растворимые соли Серебра или на водные суспензии его солей. Растворимость Ag2S в воде 2,48·10-3 моль/л (25 °С). Известны аналогичные соединения — селенид Ag2Se и теллурид Ag2Te.
Серебро легко вытесняется более активными металлами из своих соединений. Углем, водородом и другими восстановителями серебро восстанавливается до металла. Например, образование тонкого слоя серебра на чистой стеклянной поверхности при взаимодействии альдегида с аммиачным раствором соли серебра:
2[Ag(NH3)2]NO3 + 2H2O + HCOH = 2Ag↓ + HCOONH4 + 2NH4NO3 + NH3·H2O.
Стандартный электродный потенциал пары Ag+/Ag0 0,799В, в неокисляющих кислотах серебро не растворяется. С кислотами-окислителями, особенно с HNO3 активно взаимодействует:
3Ag + 4HNO3 (30%-ная) = 3AgNO3 + NO↑ + 2H2O.
При нагревании серебро реагирует с концентрированной серной кислотой:
2Ag + 2H2SO4 (конц.) = Ag2SO4 + SO2↑ + 2H2O.
При комнатной температуре не окисляется кислородом воздуха, при 170 °C его поверхность покрывается пленкой Ag2O. Озон в присутствии влаги окисляет серебро до высших оксидов AgO или Ag2O3. Оксид серебра(I) Ag2O выпадает в осадок при добавлении щёлочи к растворам солей серебра (I), так как гидроксид серебра AgOH неустойчив и разлагается на оксид и воду:
2AgNO3 + 2NaOH = Ag2O↓ + 2NaNO3 + H2O.
При нагревании Ag2O разлагается на простые вещества:
2Ag2O = 4Ag + O2
На воздухе в присутствии сероводорода серебро окисляется до сульфида:
4Ag + O2 + 2H2S = 2Ag2S + 2H2O.
Химические свойства серебра
Химические свойства серебра
По своей химической активности серебро занимает промежуточное положение между золотом и медью. С кислородом серебро непосредственно не соединяется, но в расплавленном состоянии растворяет около 20 объемов кислорода на один объем металла. В твердом серебре растворимость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопровождающееся иногда разбрызгиванием металла.
С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов. При нагревании с серой серебро легко образует сульфид Ag2S. Это же соединение получается при действии на серебро газообразной серы, выделяющейся при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами.
При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных условиях и является причиной постепенного потемнения серебянных изделий. Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают, даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света.
Электродный потенциал серебра в водных растворах высок
Ag =>Ag + + e, E0 = + 0,799В.
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной.
Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl. Такие различия в поведении золота и серебра часто используют для разделения этих металлов.
Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомочевины в присутствии солей железа (III).
В подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют.
Оксид серебра Ag2O черно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag+. Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид:
Ag+ + ОН-= AgOH
2AgOH = Ag2O + Н2O
Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гидролизуются и дают нейтральную реакцию. При нагревании до 185 — 190 °С Ag2O разлагается на элементы. Перекись водорода легко восстанавливается Ag2O уже при комнатной температуре:
Ag2O + Н2O2 = 2Ag + Н2O + O2.
В водном растворе аммиака Ag2O растворяется с образованием комплексного соединения:
Ag2O + 4NH4OH = 2Ag(NH3)2OH + 3H2O
При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро).
Галогениды серебра — малорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и иодид Agl выпадают в осадок при введении в раствор, содержащий ионы Ag+ (например, раствор AgNO3), ионов Cl, Вr и I. Их произведения растворимости составляют соответственно 1,8-10-10 (AgCl), 5,3-10-13 (AgBr) и 8,310-17 (Agl).
В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НСl. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000°С.
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN-, S2O3—, SO32-, Сl—, Nh4, CS(Nh3)2 и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например:
AgCl + 2CN— = Ag (CN)2 + Сl—
AgCl + 2S2O32- = Ag(S2O2)23- + Сl—
AgCl + 2NH4OH = Ag(NH3)2+ + Сl— + 2H2O
Вследствие образования комплексов с ионами Сl- хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов:
AgCl + Сl— = AgCl2—
Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7-10-3 моль/л (0,72 г/л Ag) против 1,3-10-5 в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига.
Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в результате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора.
Электроотрицательными металлами (цинком, железом) хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве.
Бромид серебра AgBr похож по своим свойствам на AgCl. Он растворим в аммиачных, тиосульфатных, сульфитных и цианистых растворах, легко восстанавливается до металла.
Иодид серебра AgI — наименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN— и S2O3— , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью AgI обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов AgI2-.
Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувствительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид:
2AgГ= 2Ag+Г2
Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов — веточувствительных пленок, пластинок и бумаги. Светочувствительность галоидов серебра возрастает в ряду AgI<AgCl<AgBr, поэтому чаще всего для производства фотоматериалов используют бромид серебра.
К галогенидам серебра очень близок по своим свойствам цианид серебра AgCN. Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag+, раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3-10-16) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается.
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgNO3 получают действием азотной кислоты на металлическое серебро:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Нитрат серебра представляет собой бесцветные негигроскопические кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается.
AgNO3 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100°С она возрастает до 952 г на 100 г.
В присутствии органических веществ нитрат серебра чернеет вследствие частичного восстановления до металла.
Нитрат серебра — технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNO3 используют в качестве электролита при электролитическом рафинировании серебра.
Сульфат серебра Ag2SO4 может быть получен растворением металлического серебра в горячей концентрированной серной кислоте:
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O
Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660 °С. При температуре выше 1000 °С термически разлагается. Растворимость Ag2SO4 в воде невелика, при 25 °С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHSO4.
Сульфид серебра Ag2S — наиболее трудно растворимая соль этого металла (произведение растворимости 6.3×10-50). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии h3S на металлическое серебро в присутствии влаги и кислорода воздуха:
4Ag + 2H2S + O2 = 2Ag2S + 2Н2O
Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой.
В цианистых растворах Ag2S растворяется в результате образования комплексного соединения:
Ag2S + 4CN- = 2Ag (CN)2- + S2-
Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN— и удаление ионов S2- окислением их кислородом продуваемого воздуха.
С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы:
Ag2S + O2 = 2Ag + SO2
Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха:
4Ag + 8CN— + O2 + 2Н2O = 4Ag(CN)2 + 4OН—
Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования.
Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III), образуя комплексные катионы Ag[CS (NH2)2]2+.
Аффинаж серебра в домашних условиях — Знаешь как
Что такое аффинаж серебра в домашних условиях
Содержание статьи
Для того чтобы произвести аффинаж серебра в домашних условиях потребуется любые материалы перечисленные ниже :
Окисление серебра Азотной кислотой
Самый лучший из вариантов это растворение серебра с последующим восстановлением в Азотной кислоте . Азотная кислота одна из немногих которая может растворить практически все металлы не считая Благородных , но и у благородных металлов есть исключения есть исключение например палладий который растворяется не только в азотной но и соляной кислоте в присутствии свободного хлора Cl .Растворение серебра в азотной кислоте происходит при нормальных и не нуждается в дополнительных каких либо условий , но для ускорения реакции рекомендуется нагревать техническое серебро из кислоту .На затруднение в растворении может повлиять и другие факторы например нахождение в сплаве золотом и платиной или другим благородным металлом , для растворения то кого материала потребуются другие химические реакции .В термостойкую колбу нужно поместить техническое серебро нуждающейся в очистке и залить концентрированной Азотной кислотой HNO3 . Поставить на нагревательный прибор , поместить в шкаф с принудительной вентиляцией , это нужно для вашей защиты от выделяющихся газов оксида азота NO2 .
AgCuPb + HNO3 → AgNO3 + CuNO3 +Pb2NO3
AgNO3 + CuNO3 +Pb2NO3 + NaCl → Cu2Cl- + Pb2Cl- +AgCl
После полного растворения серебра в кислоте нужно дать остыть , добавить простой воды и дать некоторое время отстоятся . Далее нужно аккуратно отфильтровать жидкую часть от осадка если понадобиться ещё раз долить воды дать отстоятся и профильтровать . Осадок на дне может быть каким нибудь другим металлом который не растворяется в азотной кислоте не исключёно , что это даже благородный металл .
В отфильтрованную жидкость которая представляет собой смесь множества солей металлов которые входили в состав технического серебра , нужно добавить раствор хлорида натрия NaCl ( кухонная соль ) в результате произойдёт мгновенная реакция с образованием хлорида серебра который осядет на дно колбы в виде крупного белого творожистого осадка данная реакция называется качественной реакцией на серебро . Получившийся хлорид серебра нужно тщательно промыть , а воду с промывки пропустить через прибор для для декантации для отделения унесённых частичек хлорида серебра .Хлорид серебра поместить в термостойкую колбу залить водой и добавить глюкозы для удаления нежелательной примеси солей меди которые остались после реакции по осаждению .
Как восстановить серебро
Восстановление хлорида серебра в серебро
Для восстановления серебра из их хлоридов понадобиться :
1 Пищевая сода .
Реакция протекает при нагревании с образованием простого вещества серебра , хлорида натрия , углекислого газа и кислорода Металлическое серебро при сильном нагревании собирается на дне тигля .
AgCl + Na2CO3 → Ag + NaCl + CO2↑ + O2↑↑
Восстановление серебра водородом
Реакция протекает в термостойкой колбе при нагревании в результате пропускания через него газообразного водорода , в результате образуется серебро и хлороводород который улетучивается от нагревания .
AgCl + h3 → HCl + Ag
Окисление серебра серной кислотой
Реакция по окислению серебра серной кислотой h3SO4 протекает аналогично как Азотной кислотой , но скорость реакции намного медленней из за своих химических свойств кислоты , также по растворимости круг металлов уменьшается как с примером Палладия серная кислота не растворяет .Также примеси благородных металлов приводят к тому , что реакция замедляется или вообще не реагирует с техническим серебром к примеру сплавы серебра с палладием для использования в контактах , отличить зрительно от простого технического серебра можно , серебро от примесей в воздухе серы покрывается налётом или тускнеет , а серебро с палладием на вид кажется новым практически не подверженный какой либо коррозии и окислению см . Палладий .
После полного или частичного растворения серебра также нужно разбавить с простой водой ( реакция проводиться ВОДА + РАСТВОР , раствор добавлять в воду так как концентрированная серная кислота реагирует с водой с нагреванием и разбрызгиванием , небольшое количество воды мгновенно испариться ) и отфильтровать . Фильтрат оставить для дальнейшего получения других более благородных металлов .
Так же как и предыдущем опыте серебро легко осаждается из раствора в виде хлорида серебра , для этого нужно добавить раствор хлорида натрия NaCl .
Получившийся хлорид серебра тщательно промыть и прокипятить с глюкозой для удаления остатков солей меди .
Восстановление аналогично как и с азотной кислотой .
Растворение серебра в соляной кислоте
Мы знаем , что взаимодействие серебра Ag с соляной кислотой HCl не приведёт не каким результатам так как серебро не растворяется в соляной кислоте , в следствии покрытия тонким слоем хлорида серебра .
Но если добавить к раствору свободного кислорода в виде перекиси водорода , то реакция сдвинутся в сторону окисления серебра в хлорид серебра.Данный процесс применим только с содержание серебра в материале не более 5% от массы , в противном случае реакция не приводит к не каким результатам . Поэтому для того чтобы растворить серебро ( сплав серебра ) его нужно предварительно расплавить с металлом который хорошо растворяется с соляной кислоте к примеру медь . Если же требуется отделить золото от серебра то в производственных масштабах расплавленный сплав выливают в воду в результате образуется мельчайшие частички сплава , далее его растворяют в соляной кислоте средней концентрации , более высокое содержание соляной кислоты приводит к потери золота .
По своим реакционным способностям в качестве окислителя в данной реакции по окислению серебра , она из за выделения свободного хлора может сразу вступать в реакцию и с другими благородными металами которые могут входить в состав сплава , так с примером палладия соляная кислота полностью растворяет его известно с других источников , что даже некоторые другие благородные металлы входящие в состав сплава такие как золото , также растворяются без остатка по реакции :
AgAu + HCl + O → AgCl + AuCl4
реакция применима только с малым содержанием золота
Как и в предыдущих реакциях также разбавить с водой и по возможности отделить от порошка примесей на дне колбы . Если данный способ не устраивает тогда нужно высушить тщательно хлорид серебра , засыпать в термостойкую колбу и добавлять до полного растворения нашатырный спирт Nh5OH ( аммиачная вода ) в результате все не растворённые осадки в кислоте останутся на дне колбы , а хлорид серебра полностью растворится :
AgCl + Nh5OH → [Ag( Nh4 )2]Cl
После полного удаления осадка в результате фильтрации к раствору нужно добавить Азотную кислоту HNO3 , в результате реакции обратно получается хлорид серебра который нужно тщательно промыть и проварить с глюкозой для удаления примесей меди .
Восстановление аналогично как и с азотной кислотой .
Взаимодействие серебра с серой
Одной из реакций для очищению серебра от примесей других металлов можно воспользоватся окислением серой . Недостаток заключается в том что присутствие каких либо благородных металлов приведёт к не протеканию термической реакции.
Описание процесса .
Нужно взять любую емкость ( глиняную , железную и так далее ) поместить желательно измельчённое техническое серебро в вперемешку с серой S и поставить нагреваться на огонь . В результате термической реакции сера прореагирует с серебром с образованием сульфида серебра , нужно учесть реакция протекает с выделением большого количества ядовитых паров .Получившийся сульфид серебра нужно нагреть при температуре плавления серебра 950 градусов в результате чего сульфид потеряет всю серу S и перейдёт в свободное состояние .
Данный процесс можно использовать как предварительное очищение серебра , сто процентов чистоты данный процесс не даёт .
Реакция серебра с хлоридом железа три
Эту реакцию по окислению серебра можно отнести только к чистому серебру для окисления или удаления с поверхностей не прибегая к реакциям с кислотам . К примеру есть множество материалов покрытых чистым серебром , а вам нужно снять это покрытие не испортив материал . Кислота просто всё испортит , а вот хлорид железа три FeCl3 наоборот аккуратно удалит серебро с покрытия и вам всего лишь нужно будет промыть его , также этот процесс можно использовать при получении золота из радиодеталей если совместно с покрытием золота есть покрытие серебра , с золотом хлорид железа не реагирует . Этот процесс называется травлением серебра хлорным железом .
Ag + FeCl3 → AgCl + FeCl2
Недостаток этой реакции в том ,что как и соляной кислотой образуется нерастворимый осадой и реакция прекращается.
Окисление серебра сероводородом
Серебро при нормальных условиях не реагирует с кислородом воздуха , но при малейших признаках сероводорода ( резина , производство , канализационные газы и т.д ) серебро приобретает тёмный оттенок , это эта реакция протекает по следующей реакции:
Ag + h3S + O2 → Ag2S + h3O
Если реакция протекает без присутствия кислорода , то выделяется водород это нужно учесть если способ окисления серебра выбран сероводород .
Ag + h3S → Ag2S + H
Восстановления серебра из сульфида серебра .
Сульфит серебра ( I ) Ag2S
Аргентит один из основных источников добычи простого вещества серебра , сульфид серебра имеет серо — чёрную окраску , при нагревании плавится без разложения . Не реагирует с кислотами на холоду . Разложение сульфида серебра с концентрированными кислотами и щелочами только при нагревании . Нагревание в прямом потоке воздуха приводит к разложению с восстановлением серебра .
Ag2S + O2 → 2Ag + SO2
Окисление серебра йодом
Серебро с галогенами окисляются до галогенидов , которые известны своими не стабильными свойствами разлагаться на свету ( кроме фторида ), реакция протекает очень медленно с образованием свободного галогена и серебра .
Восстановление серебра из йодидов .
Помимо прямого восстановления нагреванием , можно воспользоваться методом замещения иногда используют щелочные металлы такие как калий K, натрий Na.
AgI + t → Ag + I
AgI + K → KI + Ag
Оксид серебра — Знаешь как
Основное получение взаимодействие нитрата серебра с гидроксидом натрия :
2AgNO3 + NaOH → Ag2O + NaNO3 + h3O
Разложением гидроксида серебра на воду и оксид серебра :
AgOH → Ag2O + h3O
Для получения чистого оксида серебра используют электролиз в дистиллированной воде :
Ag- анод = Ag2О
Применение .
Оксид серебра используется для изготовления батареек на часы , используется в построения космических аппаратов , иногда используется в фармацевтической промышленности для создания на основе оксида серебра лекарств с антисептическими свойствами , большое количество идёт для изготовления аккумуляторов где анод оксид серебра , использование в стекольной промышленности , а также как краситель .
Реакции оксида серебра ( I )
Нагревание от ( 300 °C ) приводит к разложению на простые элементы серебро и кислород :
2Ag2O = 4Ag + O2
Нагревание до температуры ( 40 °C ) в присутствии водорода приводит к восстановлению серебра и получению воды :
Ag2О + h3 = 2Ag + Н2О
Аналогично водороду , оксид углерода ( угарный газ СО )при нагревании окисляется до углекислого СО2 восстанавливая серебро до свободного состояния :
Ag2О + CO = 2Ag + CO2
Реакция с кислотами приводит к образованию соответствующим кислотам солей , с азотной кислотой образуется нитрат серебра ( ляпис ) и вода :
Ag2O + 2HNO3 = 2AgNO3 + Н2О
Реакция с серной кислотой ( разб. ) даёт сульфат серебра :
Ag2O + h3SO4 = Ag2SO4 + h3O
Оксид серебра плохо растворим в воде и даёт очень слабощелочную реакцию :
Ag2O + h3O = 2Ag⁺ + 2OHˉ
Но легко растворяется в аммиаке , аммиачной воде ( нашатырном спирте ) , что используется для отделения солей серебра из растворов :
Ag2O + 4Nh5OH = 2[Ag(Nh4)2]OH + h3O
Вступает в реакцию с плавиковой кислотой с образованием фторида серебра :
Ag2O + 2HF = 2AgF + Н2О
Свойства
Оксид серебра Ag2O — твердое вещество , в порошкообразном состоянии имеет коричнево — черный цвет , его молярная масса 231,735 грамм на моль и плотность 7,14 грамм на см³ , температура плавления 280°C дальнейшее нагревание приводит на получение свободных веществ ( серебро , кислород ) , оксид серебра обладает светочувствительностью , проявляет амфотерные свойства .
Вы читаете, статья на тему оксид серебра
Реакция серебряного зеркала — MEL Chemistry
Очень эффектно смотрится эксперимент с красивым эффектом формирования зеркальной поверхности на стекле. Проведение этой реакции требует опыта и терпения. В нашей статье вы можете прочитать о необходимых реагентах, о том, как подготовить оборудование, и узнать химические уравнения реакций.
Сущность реакции серебряного зеркала заключается в образовании металлического слоя серебра в результате окислительно-восстановительной реакции при взаимодействии аммиачного раствора оксида серебра в присутствии альдегидов.
 «Серебряное зеркало» (слева)
«Серебряное зеркало» (слева)
[Википедия]
Для изготовления прочного слоя серебра вам понадобится:
- Колба стеклянная 100 мл;
- 2,5-4% раствор аммиака;
- нитрат серебра 2%;
- раствор формальдегида (40%).
Вместо растворов аммиака и нитрата серебра можно также использовать реагент Толленса — аммиачный раствор оксида серебра.К 10 каплям воды добавить 1 грамм нитрата серебра (если предполагается длительное хранение жидкости, храните ее в темном месте или в бутылке из темного стекла). Перед экспериментом смешайте раствор (около 3 мл) в пропорции 1/1 с 10% раствором гидроксида натрия. Может образоваться осадок серебра, который можно разбавить, медленно добавляя раствор аммиака. Также рекомендуем провести еще один эффектный эксперимент с раствором аммиака и распечатать «химическое фото».
Реакция протекает при комнатной температуре. Для успешного результата стенки стеклянной колбы должны быть идеально чистыми и гладкими. Если на стенах есть мельчайшие частицы грязи, образовавшийся осадок будет иметь вид рассыпчатого слоя черного или темно-серого цвета.
Для очистки колбы используйте разные типы щелочных растворов. Сначала используйте раствор каустической соды, а затем ополосните колбу дистиллированной водой. Промойте колбу очищающим средством много раз.
Почему так важно, чтобы емкость была чистой
Коллоидные частицы серебра, образовавшиеся в конце эксперимента, должны прочно сцепляться с поверхностью стекла, и на ней не должно быть никаких жировых или механических частиц. Дистиллированная вода не содержит солей и идеально подходит для окончательного ополаскивания колбы. Сделать его можно дома, но проще купить.
Уравнение, описывающее первую стадию реакции серебряного зеркала:
Ag₂O + 4 NH₃ · Н₂О ⇄ 2 [Ag (NН₃) ₂] ОН + 3Н₂О
где [Ag (NН₃) ₂] ОН — гидроксид диамина серебра, полученный растворением оксида металла в растворе аммиака.
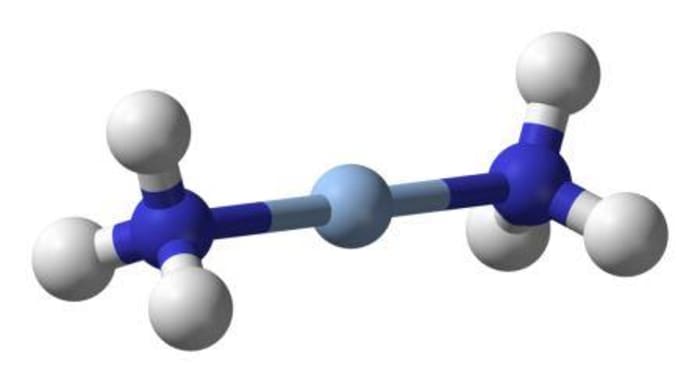 Шаровидная модель комплекса диамминосеребра (I)
Шаровидная модель комплекса диамминосеребра (I)
[Википедия]
NB Соблюдайте требования к концентрации аммиака, реакция возможна при низких концентрациях!
Последнюю стадию реакции можно исследовать с помощью следующего уравнения:
R-CH = O + 2 [Ag (NH₃) ₂] OH → 2Ag ↓ + R-COONH₄ + 3NH₃ + H₂O (реакция альдегида R-CH = O и раствора гидроксида диамина серебра дает осадок серебра, угольную кислоту амид и раствор аммиака; где R представляет собой органическую функциональную группу)
Вторую стадию реакции лучше проводить, осторожно нагревая колбу на горелке, тогда процесс должен протекать без проблем.
Что может показать реакция серебряного зеркала
Эта интересная химическая реакция не только позволяет нам исследовать определенные состояния вещества, но также может дать точное определение альдегидов. Эта реакция отвечает на вопрос: есть ли в растворе альдегидная группа или нет?
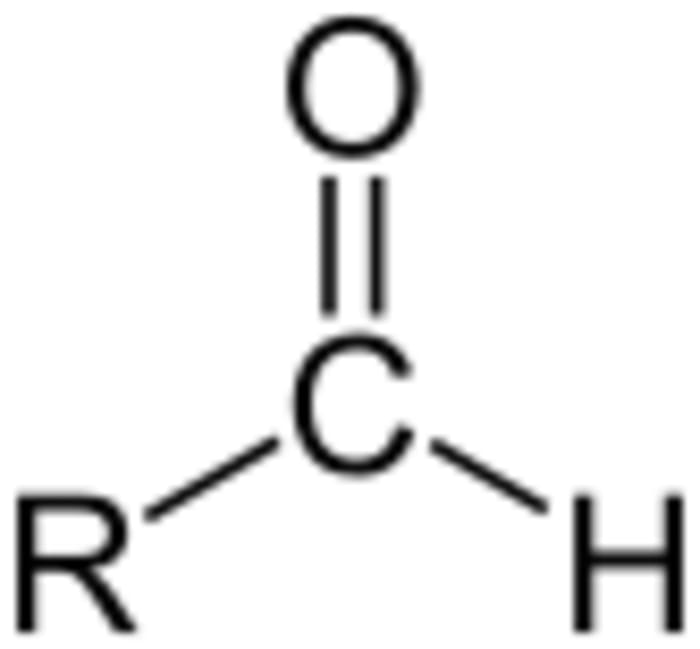 Формула альдегидной группы
Формула альдегидной группы
[Википедия]
Например, благодаря этому процессу мы можем узнать, какой компонент содержит раствор: глюкозу или фруктозу.Глюкоза дает положительный результат, образуется «серебряное зеркало», а фруктоза содержит кетоновую группу и не может образовывать осадок серебра. Для проведения анализа вместо формальдегидного раствора следует добавить 10% раствор глюкозы. Давайте посмотрим на уравнение, чтобы понять, почему и как растворенное серебро превращается в твердый осадок:
2 [Ag (NH₃) ₂] OH + 3H₂O + C₆H₁₂O₆ (глюкоза) = 2Ag ↓ + 4NH₃ ∙ H₂O + C₆H₁₂O₇ (формы глюконовой кислоты).
,
Удаление потускнения с серебра — Сложный процент
Серебро тускнеет на воздухе с образованием черного покрытия из сульфида серебра, имеющего формулу Ag 2 S. Химическое уравнение образования потускнения серебра в результате реакции с сероводородом (H 2 S) выглядит следующим образом:
2 Ag (с) + H 2 S (г) → Ag 2 S (с) + H 2 (г)
Есть предположение, что в настоящее время потускнение серебра на самом деле происходит быстрее из-за повышенного количества сероводорода, выбрасываемого в атмосферу в результате сжигания ископаемого топлива и т.п.Этот налет из-за сульфида серебра можно довольно легко удалить, используя полироли, содержащие абразивные вещества для стирания сульфида серебра, но у них есть недостаток, заключающийся в удалении небольшого количества серебра. К счастью, химия предлагает метод, который позволяет обойти эту проблему.
В этом простом методе всего лишь используется алюминиевая фольга, кипящая вода, бикарбонат соды (гидрокарбонат натрия) и поваренная соль (хлорид натрия). Выровняйте миску с фольгой, добавьте примерно чайную ложку бикарбоната соды и немного соли, затем просто добавьте кипяток.Затем потускневший серебряный предмет можно поместить в воду, убедившись, что есть контакт между ним и алюминиевой фольгой, и потускнение сульфида серебра быстро исчезнет.
Химический состав этой реакции относительно прост, но на удивление сложно найти полное объяснение в Интернете, которое также полностью описывает происходящие химические реакции и причины включения пищевой соды и соли, так что это моя попытка исправить это.
Алюминий имеет более сильное сродство к сере, чем серебро, поэтому в этой реакции алюминий просто вытесняет серебро из соединения сульфида серебра, чтобы высвободить металлическое серебро и образовать соединение сульфида алюминия:
3 Ag 2 S (с) + 2 Al (с) → 6 Ag (с) + Al 2 S 3 (с)
Сама реакция на самом деле является электрохимической реакцией — по сути, крошечный электрический ток течет между серебром и алюминием, когда они находятся в контакте, и серебро в сульфиде серебра восстанавливается (приобретает электроны) с образованием металлического серебра, в то время как алюминий окисляется (теряет электроны) с образованием ионов Al 3+ :
3 Ag + + 3 e — → 3 Ag
Al → Al 3+ + 3e
Объединение этих двух полууравнений дает нам полное окислительно-восстановительное уравнение для реакции:
Al + 3 Ag + → Al 3+ + 3 Ag
Это объяснение прекрасное, но не объясняет потребности в бикарбонате соды или соли во время реакции — и оба они являются жизненно важными компонентами.Бикарбонат натрия требуется для удаления тонкого слоя гидроксида алюминия, который образуется на алюминиевой фольге; без этого реакция не смогла бы получить готовый запас ионов алюминия и как таковая не могла бы продолжаться. В результате реакции между ними также образуется водород, который не играет никакой роли в удалении серебряного налета и просто выделяется в виде газа. Соль, тем временем, действует как «солевой мостик» — это способствует переносу электронов по мере развития реакции, предотвращая дисбаланс заряда и позволяя протекать реакциям окисления и восстановления.
При проведении этой процедуры вы также можете заметить слабый запах яиц — это связано с последующими реакциями, которые могут возникнуть. Сульфид алюминия может реагировать с водой следующим образом:
Al 2 S 3 (с) + 6 H 2 O (л) → 2 Al (OH) 3 (водн.) + 3 H 2 S (г)
Сероводород, H 2 S, на самом деле тот же газ, который выделяют тухлые яйца — отсюда и запах!
,
Реакция алкилгалогенидов с нитратом серебра
На этой странице показано, как раствор нитрата серебра можно использовать как часть теста на галогеноалканы (галогеналканы или алкилгалогениды), а также как средство измерения их относительной реакционной способности.
Тест на галогеноалканы
Раствор нитрата серебра можно использовать для определения того, какой галоген присутствует в предполагаемом галогеналкане. Самый эффективный способ — провести реакцию замещения, которая превращает галоген в галогенид-ион, а затем проверить этот ион с помощью раствора нитрата серебра.- \]
с \ (X \) — любой галогенный атом.
Нет необходимости доводить эту реакцию до завершения. Тест с нитратом серебра достаточно чувствителен, чтобы обнаруживать довольно небольшие концентрации галогенид-ионов. Смесь подкисляют, добавляя разбавленную азотную кислоту. Это предотвращает реакцию непрореагировавших гидроксид-ионов с ионами серебра. Затем добавляют раствор нитрата серебра. В результате реакции между ионами серебра и галогенида могут образовываться различные осадки:
| ион присутствует | наблюдение |
|---|---|
| Класс — | белый осадок |
| Br — | очень бледно-кремовый осадок |
| I — | Осадок очень бледно-желтый |
Подтверждающие осадки
На самом деле, эти цвета довольно сложно различить, особенно если нет большого количества осадков.Вы можете определить, какой у вас осадок, добавив раствор аммиака.
| исходный осадок | наблюдение |
|---|---|
| AgCl | осадок растворяется с образованием бесцветного раствора |
| AgBr | осадок практически не изменяется при использовании разбавленного раствора аммиака, но растворяется в концентрированном растворе аммиака с образованием бесцветного раствора |
| AgI | осадок не растворим в растворе аммиака любой концентрации |
Сравнение реакционной способности галогеноалканов
В этом случае различные галогеноалканы обрабатывают раствором нитрата серебра в смеси этанола и воды.Больше ничего не добавлено. По прошествии разного времени осадки появляются, когда ионы галогенида (образующиеся в результате реакций галогеноалканов) реагируют с присутствующими ионами серебра. Пока вы делаете все в контролируемых условиях (одинаковое количество всего, одинаковая температура и так далее), затраченное время дает хорошее представление о реакционной способности галогеноалканов — чем быстрее появляется осадок, тем более реакционноспособен галогеноалкан.
Галогенид-ион образуется одним из двух способов в зависимости от типа присутствующего галогеноалкана — первичного, вторичного или третичного.-} \]
Вторичные галогеноалканы частично выполняют и то и другое.
Сравнение скоростей реакции при смене галогена
Вы должны поддерживать постоянный тип галогеноалкана (первичный, вторичный или третичный), но изменять галоген. Вы можете, например, сравнить время, необходимое для образования осадка из этой серии первичных галогеноалканов:
Очевидно, время, необходимое для появления осадка галогенида серебра, будет зависеть от того, сколько всего вы используете, и от температуры, при которой проводится реакция.Но картина результатов всегда одна и та же. Например:
- Первичное соединение йода довольно быстро образует осадок.
- Для образования осадка первичного бромсодержащего соединения требуется больше времени.
- Соединение первичного хлора, вероятно, не даст осадка, пока вы не потеряете интерес ко всему этому!
Порядок реакционной способности отражает прочность связей углерод-галоген. Связь углерод-йод — самая слабая, а углерод-хлор — самая сильная из трех связей.Для образования галогенид-иона необходимо разорвать связь углерод-галоген. Чем слабее связь, тем легче.
Если вы изучили механизмы этих реакций, вы узнаете, что неподеленная пара в молекуле воды атакует слегка положительный атом углерода, присоединенный к галогену. Это немного положительно, потому что большинство галогенов более электроотрицательно, чем углерод, и поэтому оттягивают электроны от углерода.
Заманчиво думать, что реакция будет быстрее, если разница электроотрицательностей больше.Небольшой положительный заряд на углероде будет больше, если он присоединен к атому хлора, чем к атому йода.
Это означает, что между неподеленной парой на воде и атомом углерода, присоединенным к атому хлора, будет больше притяжения, чем если бы он был присоединен к атому йода. Разница в электроотрицательности углерода и йода незначительна.
Однако самая быстрая реакция — с йодалканом. В этих реакциях прочность связи является основным фактором, определяющим относительные скорости реакции.
Сравнение скоростей реакции первичных, вторичных и третичных галогеноалканов
Вам нужно поддерживать постоянный атом галогена. Обычно используют бромиды, потому что они имеют умеренную скорость реакции. Вы можете, например, сравнить реакционную способность этих соединений:
Опять же, фактическое время будет варьироваться в зависимости от условий реакции, но картина всегда будет одинаковой. Например:
- Третичный галогенид почти мгновенно образует осадок.
- Вторичный галогенид через несколько секунд дает легкий осадок. Осадок со временем загустевает.
- Для образования осадка первичного галогенида может потребоваться значительно больше времени.
Причину этого объяснить сложнее, поскольку для этого необходимо достаточно глубокое знание механизмов, участвующих в реакциях. Он отражает изменение способа образования галогенид-иона при переходе от первичных ко вторичным и третичным галогеноалканам.
,
Мифы и противоречия об очистке серебра
Хотя многие могут не согласиться, я предпочитаю удалять потускнение с моих серебряных украшений или изделий из серебра, химически обращая реальный процесс потускнения. Я использую три простых ингредиента для дома: воду, алюминиевую фольгу и пищевую соду. Попробуйте поискать эти ингредиенты, и вы найдете удивительно последовательные инструкции на нескольких веб-сайтах: положите свои украшения или серебро поверх мятой алюминиевой фольги и обильно посыпьте их пищевой содой.Залить кипятком, пока украшение не будет покрыто. Подождите 10 минут, снимите украшение и сполосните его под горячей водой. Промокните до полного высыхания и оставьте на ночь. При необходимости повторите.
Это все достаточно просто, но я обнаружил, что задаюсь вопросом: «Почему 10 минут? Что, если что-то действительно запятнано? Почему бы не оставить его подольше? » «А почему вода должна быть кипящей?» Большинство веб-сайтов довольно категоричны по обоим пунктам: не более 10 минут, и да, вода должна быть кипящей.
С химической точки зрения потускнение — это сульфид серебра, и его можно восстановить обратно до серебра в классической окислительно-восстановительной электрохимической реакции. Потускневшее серебро (катод) находится в непосредственном контакте с анодом (алюминием) в ванне с соленой водой (раствор пищевой соды). Морская вода способствует перемещению электронов между серебром и алюминием. Поскольку алюминий имеет гораздо более высокое сродство к атомам серы, чем серебро, ион серебра восстанавливается обратно до серебра, и высвобождаются ионы сульфида.Они связываются с алюминием с образованием сульфида алюминия. Алюминий разъедает, и серебро блестит.
Кинетическая реакция между серебром, сероводородом и алюминием
Окислительно-восстановительные реакции являются кинетическими. Это означает, что электроны и ионы движутся вперед и назад между серебром и алюминием. Таким образом, хотя в основном алюминий окисляется (корродирует), а серебро восстанавливается, крошечный кусочек алюминия также восстанавливается, а крошечный кусочек серебра окисляется. Я мог представить, что, скажем, через 10 минут кинетика изменится так, что серебро будет корродировать больше, чем алюминий.Например, если весь доступный алюминий превратится в сульфид алюминия, кинетика может измениться, и серебро может снова потускнеть.
Мне было труднее с утверждением о кипятке. Конечно, кипящая вода заставит ионы двигаться быстрее, ускоряя все, но, конечно, вы могли бы получить те же результаты с более прохладной водой? Это был важный вопрос, потому что иногда, когда вы ополаскиваете нежные украшения после того, как они были в кипящей воде, резкое изменение температуры может треснуть их (вы всегда должны ополаскивать украшения в очень горячей воде, чтобы избежать этого).Кроме того, если у вас есть камни, которые были закреплены клеем, более холодная вода может немного снизить вероятность ослабления адгезии, чем кипящая вода. Я решил проверить эти и другие вопросы в серии экспериментов.
Вам действительно нужно удалить серебро через 10 минут?
Для первого эксперимента я взял пару сильно потускневших сережек и поместил одну в ванну с алюминиевой фольгой и соленой водой на стандартные 10 минут. Другой я поместил в ванну на 20 минут.За исключением времени, все остальное я оставил прежним: я использовал одинаковое количество воды для каждой ванны, одинаковое количество алюминиевой фольги и такое же количество пищевой соды.
Как вы можете видеть на фотографиях «После», между двумя серьгами не было большой разницы, хотя, возможно, было намек на меньше потускнения после 20-минутной ванны. Конечно, 20-минутная серьга не стала , а потускнела, что говорит о том, что можно было бы оставить серебро в ванне более чем на 10 минут.
Вам действительно нужен кипяток?
Для второго эксперимента я взял вторую пару серег, тоже сильно потускневших. Я поместил один в кипящий раствор пищевой соды, а другой поместил в просто теплый водный раствор пищевой соды (125 градусов из-под крана, если кому-то интересно). Как и в первом эксперименте, я оставил все то же самое. Я использовал одинаковое количество воды, пищевой соды и алюминиевой фольги для обоих. Узнав, что 20 минут — это как минимум 10, я держал каждую сережку в соответствующей ванне ровно 20 минут.
Как вы можете видеть, серьга, помещенная в кипящую воду, заметно менее потускнела, чем серьга, помещенная в теплую водопроводную воду, но та, что была помещена в теплую водопроводную воду, по-прежнему заметно менее потускнела, чем была до очистки. Это говорит о том, что окислительно-восстановительная реакция все еще протекает с теплой водой, но не так быстро. Если по какой-то причине вам нужно избегать кипячения воды, просто используйте водопроводную воду.
Вам действительно нужно использовать чистую посуду из пирекса для хранения всего?
Использование чистой посуды из пирекса для хранения алюминия, воды, серебра и пищевой соды состоит в том, чтобы избежать попадания в ванну других металлов.Другие металлы могут иметь меньшее сродство к сульфиду, чем серебро. Когда это произойдет, вы действительно можете увеличить потускнение своего серебра. Если вы используете металлическую посуду, она может иметь большее сродство к сульфиду, чем алюминий. В этом случае сковорода потускнеет. Очищая серебро, я создаю отдельные алюминиевые «лодочки» для каждого украшения. Поскольку водяная баня никогда не соприкасается с поддоном, я не обнаружил разницы между использованием пирекса, пластика или обычного стекла. Однако даже я бы никогда не стал использовать металлическую сковороду! Слишком велика вероятность того, что нежелательные ионы металлов попадут в ванну с соленой водой.
Алюминий должен быть блестящей стороной вверх?
Нет. Блестящий и тусклый вид алюминия — это всего лишь функция роликов, используемых для вдавливания алюминия в фольгу. Химические и физические свойства алюминия не различаются в зависимости от того, какую сторону вы используете. Кстати, это относится и к кулинарии. Неважно, закрываете ли вы индейку блестящей стороной вверх или тусклой стороной вверх. Я не стал делать для этого эксперимента.
Нужно ли мять алюминиевую фольгу?
Это зависит.Для изогнутых серебряных предметов или предметов неправильной формы смятие фольги может увеличить прямой контакт между ней и серебряным предметом. Это помогает ускорить удаление пятен. Для прямых гладких деталей прямой контакт может быть лучше у плоской фольги.
Предотвращение потускнения и окисления
Конечно, вам никогда бы не понадобилось удалять налет серебра, если бы он изначально не накапливался. Чтобы предотвратить потускнение и окисление, нужно сначала понять причины. Потускнение, как упоминалось ранее, представляет собой образование сульфида серебра на поверхности серебра.Эта реакция должна происходить в тонкой пленке воды на поверхности серебра. Когда относительная влажность достигает 70-80%, как это может случиться при уличной торговле, реакция потускнения резко ускоряется. При относительной влажности ниже 50% потускнение все еще происходит, но скорость изменения относительно постоянна.
Химические примеси в воздухе, включая органические сульфиды, оксид азота и хлор, также ускоряют реакцию потускнения. К счастью, это обычно происходит при очень низких концентрациях.Соли человеческого пота и воздействия газообразного хлора из отбеливающих средств или бассейнов встречаются гораздо чаще и могут реагировать с серебром с образованием хлорида серебра. Хлорид серебра обычно белый или прозрачный, но может потемнеть при смешивании с сажей или грязью.
Хотя это не окисление и не потускнение, ультрафиолетовое излучение может уменьшить ионизированное серебро и создать мелкие частицы серебра, которые кажутся черными.
Советы по предотвращению потускнения и окисления
Теперь, когда вы знаете основные причины потускнения и окисления, следующие советы будут иметь больше смысла:
- Храните серебряные украшения в коробке вдали от света и чистящих средств.
Храните серебряные украшения в пакетах с силикагелем, чтобы снизить местную влажность.
Оберните серебряные украшения в ювелирную ткань. Ткань пропитана мелкими частицами серебра. Чистое серебро вступает в реакцию с сульфидом «прежде, чем достигнет» вашего серебра.
Чтобы действительно исключить влажность и предотвратить потускнение, вы можете обернуть свое серебро ювелирной тканью, бросить его в коробку с пакетами силикагеля, а затем поместить все приспособление в пластиковый пакет Pro-Tectant Anti-Tarnish Anti-Rust.Или толстый пластиковый пакет (например, 2 мил).
Если в вашем районе проблема загрязнения, подумайте также о хранении серебра с химическими адсорбентами, такими как оксид цинка или активированный уголь.
Протирайте серебряные украшения мягкой тканью после каждого использования
- Не носить серебряные украшения во время плавания
Лакирование серебра также удаляет воду с поверхности, предотвращает воздействие микрозагрязнителей на серебро и поглощает УФ-излучение.Однако со временем все лаки разрушаются, и их необходимо наносить повторно. Некоторые люди также могут реагировать на различные химические вещества в лаках. Покрытие родием дороже, но потенциально долговечнее. Это тоже со временем нужно будет переделать. Если у вас нет собственного устройства для нанесения покрытия, вам понадобится ювелир, который сделает это за вас.
Полировальная одежда, салфетки для ювелирных изделий, обмазки для ювелирных изделий и пены для полировки физически и химически удаляют молекулы потускнения (то есть сульфида серебра) с ваших ювелирных изделий.Если у вас есть цельный серебряный предмет, это медленное удаление молекул серебра не будет проблемой. Однако для очень тонких серебряных изделий существует риск полного удаления серебра. Поскольку метод пищевой соды / алюминиевой фольги фактически восстанавливает серебро, я предпочитаю его для изделий с покрытием.
Что делать, если ваше серебро украшено драгоценными камнями?
Большинство драгоценных камней прекрасно переносят ванну с пищевой содой и горячей водой, включая жемчуг. Драгоценные камни, закрепленные с помощью клея, следует подвергать процессу очистки , а не .Водорастворимые клеи могут растворяться, и даже нерастворимые в воде клеи могут размягчаться и разрыхляться. Драгоценные камни, которые большинство авторитетов не рекомендует помещать в пищевую соду или горячую воду, включают янтарь и коралл. Я согласен с этим, исходя из личного опыта.
Власти более неоднозначны в отношении того, можно ли обрабатывать опалы пищевой содой и горячей водой: одни говорят, что только опалы Welo находятся под угрозой, а другие утверждают, что опал не должен подаваться. Власти также разошлись во мнениях относительно того, можно ли подвергнуть бирюзу этому процессу очистки.Я кладу бирюзу в алюминиевую / морскую / горячую ванну. Выходит нормально, но всегда требует повторной полировки. Моя личная рекомендация? Если есть сомнения, не делайте этого.
Благодарности
Я в долгу перед Масамицу Инаба за его обсуждение химии образования и предотвращения потускнения.
Я также признателен вам за то, что вы прочитали мою статью. Если вам понравилось или вы узнали что-то новое, оставьте, пожалуйста, комментарий или оценку.
,